
Кровесберегающие технологии в акушерской практике. Клинические рекомендации (протокол лечения)
Кровесберегающие технологии в акушерской практике (утв. Российским обществом акушеров-гинекологов 15 мая 2014 г.)
Клинические рекомендации (протокол лечения)
|
Коллектив авторов: |
|
|
Сухих |
директор ФГБУ "НЦАГиП им.В.И.Кулакова" Минздрава России, академик РАН, профессор, д.м.н. |
|
Серов |
президент российского общества акушеров-гинекологов, академик РАН, профессор |
|
Адамян |
заместитель директора ФГБУ "НЦАГиП им.В.И.Кулакова" Минздрава России, главный внештатный акушер-гинеколог Минздрава России, академик РАН, профессор, д.м.н. |
|
Федорова |
заведующий отделением гравитационной хирургии крови ФГБУ "НЦ АГиП им.В.И.Кулакова" Минздрава России, профессор, д.м.н. |
|
Рогачевский |
ведущий научный сотрудник отделения гравитационной хирургии крови ФГБУ "НЦ АГиП им.В.И.Кулакова" Минздрава России, д.м.н. |
|
Башмакова |
директор ФГБУ "Уральский НИИ ОММ" Минздрава России главный акушер-гинеколог Уральского федерального округа, профессор, д.м.н. |
|
Кан |
главный врач ФГБУ "НЦ АГиП им.В.И.Кулакова" Минздрава России, д.м.н. |
|
Тютюнник |
заведующий 2 акушерским отделением ФГБУ "НЦАГиП им.В.И.Кулакова" Минздрава России, д.м.н. |
|
Баев |
заведующий 1 акушерским отделением ФГБУ "НЦ АГиП им.В.И.Кулакова" Минздрава России, профессор, д.м.н. |
|
Тетруашвили |
заведующий 2 акушерским отделением патологии беременности ФГБУ "НЦАГиП им.В.И.Кулакова" Минздрава России, д.м.н. |
|
Филиппов |
заместитель директора Департамента медицинской помощи детям и службы родовспоможения, профессор кафедры акушерства и гинекологии ФППО ГБОУ ВПО "Первый МГМУ им.И.М.Сеченова" Минздрава России, д.м.н., профессор |
|
Виноградова |
старший научный сотрудник отделения гравитационной хирургии крови ФГБУ "НЦ АГиП им.В.И.Кулакова" Минздрава России, к.м.н. |
|
Стрельникова |
врач акушер-гинеколог, врач трансфузиолог отделения гравитационной хирургии крови ФГБУ "НЦАГиП им.В.И.Кулакова" Минздрава России, к.м.н. |
|
Бакуридзе |
врач акушер-гинеколог, врач трансфузиолог отделения гравитационной хирургии крови ФГБУ "НЦАГиП им.В.И.Кулакова" Минздрава России, к.м.н. |
|
Быстрых |
врач иммунолог, врач трансфузиолог отделения гравитационной хирургии крови ФГБУ |
|
Рецензенты: |
|
|
Радзинский |
заведующий кафедрой акушерства и гинекологии с курсом перинатологии медицинского факультета ГБОУ ВПО "РУДН" Минобрнауки России, доктор медицинских наук, профессор |
|
Макаров |
заведующий кафедрой акушерства и гинекологии ГБОУ ВПО "РНИМУ им.Н.И.Пирогова" Минздрава России, профессор, д.м.н. |
|
Лубнин |
руководитель отдела анестезиологии-реаниматологии и интенсивной терапии ФГБУ "НИИ нейрохирургии им.акад.Н.Н.Бурденко" РАМН, председатель Московского научного общества анестезиологов и реаниматологов, профессор, д.м.н. |
Аннотация
В рекомендациях представлены основные методы кровесбережения, используемые в акушерской практике. Доказательной базой для рекомендаций являются публикации, вошедшие в Кохрайновскую библиотеку, базы данных EMBASE, PUBMED и MEDLINE.
Оценка значимости рекомендаций приведена в соответствии с классификацией уровней их достоверности и доказательности (рейтинговой схемой (Приложение N 1).
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать прежде всего то, насколько интерпретация доказательств, лежащих в основе рекомендаций доступна для понимания.
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Сила рекомендаций, уровни доказательств и индикаторы доброкачественной практики - good practice points (GPPs) приводятся при изложении текста рекомендаций.
Проблема трансфузионного обеспечения в акушерстве продолжает оставаться актуальной. Современные кровосберегающие технологии, включающие в себя своевременную диагностику и коррекцию железодефицитной анемии, аутоплазмодонорство, управляемую нормоволемическую гемодилюцию, аппаратную интраоперационную реинфузию аутоэритроцитов позволяют минимизировать количество осложнений беременности, связанных с анемией, определить максимально эффективную лечебную тактику до родов, в процессе родоразрешения и в послеродовом периоде и тем самым улучшить исходы беременности в целом.
Предлагаемые технологии предназначены для врачей акушеров-гинекологов, анестезиологов-реаниматологов, трансфузиологов либо гематологов, работающих в перинатальных центрах, родильных домах, многопрофильных больницах, а также на станциях переливания крови или отделениях трансфузиологии многопрофильных лечебных учреждений.
На интраоперационном этапе широко используются нормоволемическая гемодилюция и аппаратная интраоперационная реинфузия аутоэритроцитов [1, 5, 8, 9].
При сегодняшнем дефиците качественной донорской крови и опасности заражения опасными инфекциями преимущества бескровной хирургии бесспорны. Главный же принцип - сберечь как можно больше крови человека, оказавшегося на операционном столе (Зильберт А.П., 1999).
Список сокращений
DO2I - индекс доставки кислорода
АД - артериальное давление
АЧТВ - активированное частичное тромбопластиновое время
ГЭК - гидроксиэтилированный крахмал
ДВС - диссеминированное внутрисосудистое свертывание
ЖДА - железодефицитная анемия
ИОПСС - индекс общего периферического сосудистого сопротивления
ИРА - интраоперационная реинфузия аутогэритпроцитов
ИТП - индекс тромбодинамического потенциала
КОС - кислотно основное состояние
КС - кесарево сечение
КТГ - кардиотокография
НГ - нормоволемическая гемодилюция
ОЦК - объем циркулирующей крови
ПА - плазмаферез
ПСП - показатель состояния плода
ПТИ - протромбиновый индекс
РКИ - рандомизированное контролируемое исследование
РКМФ - растворимые комплексы мономеров фибрина
СЗП - свежезамороженная плазма
СИ - сердечный индекс
УИ - ударный индекс
ЦВД - центральное венозное давление
ЧСС - частота сердечных сокращений
Введение
Как известно, в акушерстве одной из вечных проблем, над решением которых трудились многие поколения ученых, является кровотечение. Важность проблемы профилактики и лечения данного осложнения обусловлена тем, что акушерские кровотечения занимают одно из первых мест в структуре причин материнской смертности [6, 7].
Научные исследования, проводимые в этой области, позволили достичь значительных положительных сдвигов в профилактике и лечении акушерских кровотечений. Большое значение для понимания патогенеза массивных кровотечений в акушерстве имело изучение механизмов развития синдрома диссеминированного внутрисосудистого свертывания крови, как основного компонента множества патологических состояний в акушерстве.
Появившиеся в последние годы современные гемостатические средства и новые плазмозамещающие растворы позволили значительно повысить эффективность проводимой при акушерских кровотечениях инфузионно-трансфузионной терапии. Однако до настоящего времени основной проблемой данной терапии является возмещение факторов свертывания и глобулярного объема, потерянных во время кровотечения [3, 4, 8]. Многие годы эта проблема решалась за счет донорской крови и ее компонентов, недостатки трансфузии которых общеизвестны: опасность заражения вирусными инфекциями, возможность тяжелых гемотрансфузионных осложнений. Выявлены значительные сдвиги в клеточном и гуморальном иммунитете родильниц, получивших трансфузию донорских компонентов крови. Эти факторы заставили усомниться в безопасности донорской гемотрансфузии и потребовали переоценки показаний к ней.
Все это постепенно привело к мысли, что ставшее привычным переливание крови - далеко не панацея, что нужно и можно обходиться минимальной донорской помощью, а то и вовсе без нее. Сейчас такая точка зрения становится все более популярной среди специалистов.
Новейшие технологии бескровной хирургии (кровесбережения) очень быстро завоевывают все больше сторонников во всем мире. Действительно, способов сберечь кровь предостаточно, арсенал бескровной хирургии довольно обширен. Ее составными частями на предрепрационном этапе является, прежде всего, коррекция анемии имеющимися в арсенале современной медицины препаратами железа, препаратами эритропоэтина и методики аутодонорства: аутогемодонорство, аутоплазмодонорство.
Железодефицитная анемия
Определение анемии и значимость проблемы
Железодефицитная анемия (ЖДА) ( МКБ-10 D50) - синдром, характеризующийся нарушением синтеза гемоглобина вследствие дефицита железа и проявляющийся анемией. По определению Всемирной Организации Здравоохранения нижним пределом для уровня гемоглобина у беременных женщин считается <110 г/л в первом и третьем триместрах, <105 г/л во втором триместре, <100 г/л в послеродовом периоде. (CDC, 1998)
В зависимости от тяжести анемия выступает важным фактором риска заболеваемости и смертности для матери и плода [2, 22, 26, 27]. Выраженный дефицит железа способствует увеличению риска преждевременных родов, внутриутробной задержке роста и развития плода. В случае анемии средней и тяжелой степени, даже при незначительной кровопотере в родах, возникает необходимость заместительной трансфузионной терапии эритроцитсодержащими компонентами донорской крови и, соответственно, возрастает потенциальный риск осложнений, связанных с аллогенными гемотрансфузиями. В послеоперационном периоде дефицит железа способствует повышению частоты инфекционно-воспалительных осложнений. Наличие анемии перед родоразрешением ассоциируется с увеличением длительности пребывания в стационаре после родоразрешения, что приводит к повышению стоимости затрат на проводимое лечение. Предоперационная анемия ассоциируется с повышением послеоперационной смертности, повышением послеоперационной заболеваемости, увеличением длительности пребывания в стационаре после операции, ухудшением исходов лечения пациентов вне зависимости от проведения переливания крови (В-2а) [34, 44].
Причины развития анемии и ее распространенность
Наиболее распространенной причиной анемии у беременных является дефицит железа (до 95%), тем более что 40% женщин имеют нарушения обмена железа до беременности.
Недостаточный запас железа в организме, нередко обусловлен особенностями диеты (вегетарианство), хроническими заболеваниями желудочно-кишечного тракта или длительными обильными менструациями, что в связи с возрастающими потребностями в железе на фоне беременности приводит к развитию анемии [2, 47, 50].
Кроме того известно, что при беременности в организме женщины происходит ряд физиологических изменений, в том числе и со стороны крови. Общий объем плазмы увеличивается примерно на 30-50% от исходного, а глобулярный объем возрастает только на 25%. Вследствие этого повышается потребность в микроэлементах и витаминах, необходимых как для синтеза Нb, так и для обеспечения нормального развития плода и плаценты. Обусловлено это множеством факторов: нередко беременность наступает при исходно сниженном уровне Нb, и анемия диагностируется в связи с более тщательным лабораторным контролем беременных женщин [26, 28].
Диагностика железодефицитной анемии
Основа диагностики - изолированное снижение гемоглобина в общем анализе крови. Может быть выявлено уменьшение MCV, МСН (микроцитоз), однако, при нормальной беременности MCV несколько увеличивается, в связи с этим при нетяжелых формах железодефицита MCV у беременных остается в пределах нормы.
Критерии диагноза - снижение гемоглобина в общем анализе крови (менее 110 г/л), снижение ферритина сыворотки (менее 30 мг/дл).
Сывороточный ферритин - это гликопротеин, который вне воспалительного процесса четко отражает запасы железа в организме (являясь неспецифическим маркером воспаления, ферритин повышается в ответ на воспалительный процесс вне зависимости от истинных показателей феррокинетики). Но это первый и основной показатель, который снижается при недостатке железа. Кроме того, значение его не меняется в случае приема препарата железа накануне исследования (в отличие от железа сыворотки), поэтому именно ферритин является основным тестом для выявления железодефицита у беременных. Начальный этап формирования дефицита железа - истощение его запасов в организме, измеряемого уровнем сывороточного ферритина. Снижение ферритина менее 15 мг/дл является четким подтверждением железодефицита. При уровне ферритина ниже 30 мг/дл можно говорить об истощении необходимых запасов железа в организме и необходимости назначения препаратов железа во время беременности. Необходимо помнить о ложно-нормальных (либо повышенных) значениях ферритина, которые могут регистрироваться при наличии воспалительного процесса [23].
Для исключения воспалительных изменений исследуется уровень С-реактивного белка.
Следующим этапом формирования железодефицитного эритропоэза является снижение транспорта железа, измеряемого насыщением трансферрина.
Железо и общая железосвязывающая способность сыворотки являются ненадежными индикаторами обеспечения организма железом в связи с влиянием употребления железа, суточными колебаниями значений.
Дополнительными параметрами дефицита железа могут служить снижение ретикулоцитов, повышение трансферрина.
Лечение железодефицитной анемии у беременных
Терапия при подтверждении железодефицита зависит от степени выраженности анемии и наличия сопутствующих изменений.
При анемии легкой степени (гемоглобин более 90 г/л) показана терапия пероральными препаратами железа в виде солей железа (II) или полимальтозы железа (III), 160-200 мг в день предпочтительно натощак за 1 час до еды, желательно в несколько приемов. Такое же лечение применяют при истощении запасов железа на начальных этапах беременности (уровень ферритина ниже 30 мкг/л) на фоне отсутствия анемии, поскольку в период беременности потребность в железе возрастает.
В ряде случаев предпочтителен переход на внутривенное введение препаратов железа: при отсутствии ответа на прием железа внутрь (повышение уровня гемоглобина менее чем на 10 г/л через 14 дней лечения), несоблюдении назначенного лечения, непереносимости пероральных препаратов железа (побочные эффекты со стороны желудочно-кишечного тракта), стремлении быстро достичь эффекта (на поздних сроках беременности, при лечении свидетелей Иеговы и в ряде других случаев).
При большей выраженности анемии (гемоглобин менее 80-90 г/л) необходима терапия препаратами железа парентерально.
Сахарат железа (III)
Мировая практика доказала безопасность и высокую переносимость комплекса железа (III) с сахаратом. Данный препарат одобрен для применения в период беременности, начиная со второго триместра; частота возникновения побочных эффектов при применении сахарата железа ниже 0,5%. Препарат следует вводить только в учреждениях, располагающих оборудованием для сердечно-легочной реанимации. Максимальная разовая парентеральная доза сахарата железа (III) составляет 200 мг, предпочтительно развести препарат в 100 мл 0,9%-го раствора NaCl для введения в форме инфузии. Продолжительность инфузии составляет приблизительно 30 мин с использованием внутривенного доступа (следует помнить, что высокая скорость инфузии связана с риском гипотензивной реакции). В зависимости от исходных значений уровня гемоглобина внутривенное введение повторяют 1-3 раза в неделю, до повышения уровня гемоглобина >105 г/л. Затем пациента можно перевести на прием пероральных препаратов железа для поддерживающей терапии. Нет оснований ожидать возможной передозировки железом.
Карбоксимальтозат железа
В настоящее время наиболее эффективным терапевтическим подходом, позволяющим в кратчайшие сроки получить максимальный эффект, является применение карбоксимальтозата железа.
Карбоксимальтозат железа представляет новый недекстрановый комплекс железа, преимуществом которого является возможность введения высоких доз в короткий промежуток времени.
Карбоксимальтозат железа вводят в виде быстрой инфузии в течение 15-30 мин или в виде болюса в течение 1-2 мин. В виде быстрой инфузии карбоксимальтозат железа можно вводить в разовых дозах до 1000 мг железа или, соответственно, 15 мг железа в расчете на 1 кг веса тела (до уровня желаемой общей дозы); максимальная доза для внутривенного болюсного введения составляет 200 мг. Повторные инфузии проводятся еженедельно из расчета 15 мг железа на кг массы тела.
По данным Cochrane Database именно карбоксимальтозат железа является препаратом выбора терапии железодефицитной анемии при беременности. Как и в случае сахарата железа (III), данный препарат одобрен для применения в период беременности, начиная со второго триместра. В модели плацентарного кровотока показано, что карбоксимальтозат железа не проникает через плацентарный барьер к плоду. При парентеральном введении железа повышение уровня гемоглобина происходит быстрее, чем при приеме внутрь. Внутривенное введение карбоксимальтозата железа повторяют 1 раз в неделю до повышения уровня гемоглобина >100 г/л. Затем пациента можно перевести на прием пероральных препаратов железа для поддерживающей терапии. Нет оснований ожидать возможной передозировки железом. В ряде рандомизированных многоцентровых исследованиях было проведено сравнение карбоксимальтозата железа, и заместительной терапии с приемом железа внутрь при лечении анемии. Исследования показали очень высокую безопасность применения, а также высокую эффективность карбоксимальтозата железа. Применение препаратов железа для в/в введения более эффективно в отношении увеличения уровня гемоглобина по сравнению с пероральными формами (А-1b). Практическая польза, удобство для пациентов и снижение затрат, обусловленное необходимостью однократного введения, указывают на преимущество карбоксимальтозата железа перед ранее применяемым сахаратом железа (III). Благодаря этому отсутствует необходимость в дорогостоящих повторных инфузиях небольших доз железа, при этом характеризуется хорошей переносимостью [37].
Лечение тяжелой анемии. При тяжелой анемии у беременных (гемоглобин <80 г/л) оправдано введение рекомбинантного эритропоэтина (рЭПО) в дополнение к парентеральному назначению карбоксимальтозы железа. Введение рЭПО улучшает результаты лечения анемии, но только в сочетании с парентеральным введением железа. рЭПО следует назначать только в случаях тяжелой анемии при наличии дополнительных факторов (выраженные клинические симптомы, отказ от переливания донорской крови и др.). Примерная дозировка: 150 МЕ/кг веса тела один раз в сутки подкожно, суммарно четыре дозы эпоэтина альфа на фоне парентерального лечения с применением карбоксимальтозы железа. Внутривенное введение препаратов железа со стимуляторами эритропоэза сопровождается более быстрым и значимым увеличением содержания гемоглобина (А-1а) [10].
Терапия препаратами железа для в/в введения сопровождается значительным снижением риска необходимости переливания аллогенных эритроцитов (А-1а). Добавление внутривенного введения препаратов железа к лечению анемии и, следовательно, уменьшение частоты проведения переливаний крови может привести к сокращению расходов на лечение (А-1b).
Аутоплазмодонорство
Проблема профилактики акушерских кровотечений и восполнения кровопотери всегда актуальна и требует постоянного изучения и новых рациональных подходов к ее решению.
По литературным данным известно, что более 2/3 всех акушерских кровотечений связаны с нарушением состояния гемостаза, т.е. являются первично коагулопатическими.
Основным компонентом инфузионно-трансфузионной терапии при коагулопатическом кровотечении считается свежезамороженная плазма (СЗП), в которой в естественном сбалансированном состоянии сохранены все необходимые факторы, способствующие стабилизации гемостатического потенциала крови за счет восстановления баланса коагулянтной и антикоагулянтной систем [7, 11- 14].
Применяемые методы сбережения крови в предродовом и периоперационном периоде включают предварительную заготовку аутокрови и/или аутоплазмы. Преимущества кровесберегающей хирургии обусловлены отсутствием риска посттрансфузионных реакций и осложнений, передачи гемотрансмиссивных инфекций, отсутствием опасности аллоиммунизации.
В акушерстве более целесообразно использование аутоплазмодонорства, нежели аутогемотрансфузий, так как именно плазма является источником факторов свертывания крови.
Определение
Аутоплазмодонорство - метод кровесбережения, заключающийся в заготовке собственной плазмы индивидуума и предназначенный исключительно для последующей аутологичной трансфузии.
В акушерстве сущность методики заключается в сборе, замораживании и хранении плазмы женщины для последующего переливания ее во время или после родоразрешения с целью возмещения объема циркулирующей плазмы и факторов свертывания крови, а также купирования или лечения ДВС-синдрома.
Показания к заготовке и хранению аутоплазмы в акушерстве
1. Беременные группы высокого риска по развитию кровотечения.
2. Беременные с высоким риском по развитию гемотрансфузионных осложнений.
3. Беременные с редкими группами крови.
4. Отказ пациентки от переливания донорских компонентов крови, при отсутствии противопоказаний к аутодонации.
Противопоказания к заготовке аутоплазмы в акушерстве
1. Анемия - Нв<90 г/л, Ht<30%.
2. Гипопротеинемия - общий белок <60 г/л, альбумин <35 г/л.
3. Изокоагуляция не характерная сроку беременности.
4. Заболевания крови - гемофилия, тромбоцитопения и др.
5. Тяжелая экстрагенитальная патология.
6. Онкологические заболевания.
7. Тромбозы.
Показания к трансфузии аутоплазмы в акушерстве
1. Кровотечение в родах или при абдоминальном родоразрешении.
2. ДВС-синдром.
Противопоказания к трансфузии аутоплазмы в акушерстве
1. Наличие выраженной гиперкоагуляции перед родами и отсутствие кровотечения во время родов.
2. Наличие выраженной гиперкоагуляции в послеродовом или послеоперационном периоде.
Материально-техническое обеспечение технологии
1. Система сдвоенных пластиковых контейнеров для сбора, фракционирования и хранения компонентов донорской крови.
2. Центрифуга производственная рефрижераторная, предназначенная для учреждений трансфузиологии и станций переливания крови.
3. Плазмоэкстрактор ручной.
4. Ручной механический либо диэлектрический запаиватель магистралей.
5. Весы - покачиватель для крови электронные.
6. Аппарат для проведения плазмафереза с комплектом одноразовых магистралей к ним.
7. Раствор натрия хлорида изотонический физиологический (раствор NaCl 0,9%) в стеклянных бутылках или пластиковых контейнерах.
8. Коллоидный плазмозамещающий раствор гидроксиэтилированного крахмала - ГЭК (6% или 10% 200/0,5, 130/0,4) 500 мл.
9. Антикоагулянт - гепарин либо раствор АСД-А (кислая декстроза).
Технология использования метода
Заготовка аутоплазмы проводится беременным, в сроках 32-37 недель, методом прерывистого или аппаратного плазмафереза однократно или двукратно с перерывом в неделю в условиях кабинета переливания крови или отделения гравитационной хирургии крови лечебного учреждения. За проведение процедуры отвечает врач, работающий в данных подразделениях лечебного учреждения.
Обследование, необходимое для проведения аутоплазмодонорства
1. ВИЧ-1/ВИЧ2, RW, гепатит В, гепатит С;
2. Гемостазиограмма;
3. Группа крови, Rh-фактор;
4. Клинический анализ крови;
5. Общий белок крови.
Техника проведения прерывистого аутодонорского плазмафереза:
-
1. Пункция локтевой вены.
-
2. Введение плазмозамещающего раствора (физиологического раствора), количество которого определяется, исходя из общего состояния женщины, уровня артериального давления, объема удаленной плазмы и составляет 200-400 мл и гепарина который вводится внутривенно перед началом плазмафереза в дозе 2500 ЕД.
-
3. Эксфузия крови в сдвоенные пластиковые контейнеры в объеме 450-500 мл.
-
4. Введение коллоидного плазмозамещающего раствора (6% ГЭК) в объеме 500 мл.
-
5. Отделение форменных элементов крови от плазмы в рефрижераторной центрифуге при мягком режиме центрифугирования при температуре 20°С.
-
6. Полученную плазму объемом 300-350 мл переводят в контейнер-спутник, форменные элементы крови разводят 100-150 мл физиологического раствора и реинфузируют. Стабилизацию крови осуществляют за счет гемоконсерванта типа ACD находящегося в контейнере.
Техника проведения аппаратного аутодонорского плазмафереза:
-
1. Пункция локтевой вены.
-
2. Введение плазмозамещающего раствора (физиологического раствора, стерофундин изотонический), количество которого определяется, исходя из общего состояния женщины, уровня артериального давления, объема удаленной плазмы и составляет 200-400 мл и гепарина который вводится внутривенно перед началом плазмафереза в дозе 2500 ЕД.
-
3. Подключение аппарата для плазмафереза, объем эксфузии плазмы 20-25% ОЦП.
-
4. По окончании плазмафереза введение коллоидного (6% или 10% ГЭК) плазмозамещающего раствора. Соотношение объема плазмоэксфузии к объему плазмозамещения 1:1,5.
Полученная прерывистым или аппаратным методом аутоплазма маркируется "АУТОПЛАЗМА" только для аутологичной трансфузии", с указанием Ф.И.О., дата рождения, N история родов, амбулаторной карты (Приложение N 1*).
_______________
* Вероятно, ошибка оригинала. Следует читать: Приложение N 2. - Примечание изготовителя базы данных.
Полученная аутоплазма сразу же подвергается замораживанию при температуре -35°С в быстрозамораживателе и хранится при температуре -18°С. В указанном режиме аутоплазма может храниться до трех месяцев в специальном холодильнике для хранения аутоплазмы. Хранение аутоплазмы совместно с донорской свежезамороженной плазмой категорически запрещено.
Плазмоэксфузию регистрируют в журнале "Учета заготовки и переливания аутоплазмы", а в истории родов (амбулаторной карте) и обменной карте беременной делается отметка о заготовке аутоплазмы.
Во время родоразрешения аутоплазму размораживают при t - 37°C в водяной бане или специальном размораживателе и переливают женщине.
Возможные осложнения, их профилактика и купирование
Осложнения, связанные с проведением аутодонорского плазмафереза:
-
1. Аллергические реакции на консервант (проводится десенсибилизирующая терапия);
-
2. Синдром "нижней полой вены" (с целью предотвращения данного синдрома беременную укладывают на функциональную кровать в положении "на боку");
-
3. Гипотония (необходимо остановить эксфузию крови, с целью коррекции АД проводят трансфузию коллоидных и кристаллоидных растворов).
Осложнения, связанные с трансфузией аутоплазмы:
-
1. Аллергические реакции на консервант (проводится десенсибилизирующая терапия);
-
2. Выраженная гиперкоагуляция (назначается антикоагулянтная терапия).
Эффективность использования метода
Проведено обследование 212 женщин, которым в сроке 32-37 недель беременности применялось аутоплазмодонорство. Все обследованные беременные представляли группу риска по развитию кровотечения.
Для определения безопасности аутодонорского плазмафереза было проведено изучение состояния центральной и периферической гемодинамики и кислородтранспортной функции крови с использованием системы интегрального компьютерного мониторинга. В процессе исследования все беременные были разделены по типам кровообращения:
- Гиперкинетический тип - отмечался у 30% беременных;
- Эукинетический тип - отмечался у половины беременных;
- Гипокинетический тип - выявлен у 20% беременных.
При оценке гемодинамических параметров у беременных с гипер- и эукинетическим типами кровообращения на всех этапах аутодонорского плазмафереза все регистрируемые показатели находились в пределах нормативных значений. Колебания сердечного индекса (СИ) наблюдались с 5,8±1,12 л/мин/м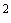 до 5,1±1,17 л/мин/м
до 5,1±1,17 л/мин/м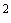 в момент эксфузии крови с последующим восстановлением во время инфузии растворов и реинфузии эритроцитов до 5,4±1,21 л/мин/м
в момент эксфузии крови с последующим восстановлением во время инфузии растворов и реинфузии эритроцитов до 5,4±1,21 л/мин/м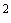 . Ударный индекс (УИ) также незначительно снизился во время эксфузии крови с 65,8±16,15 мл/м
. Ударный индекс (УИ) также незначительно снизился во время эксфузии крови с 65,8±16,15 мл/м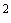 до 59,5±22,69 мл/м
до 59,5±22,69 мл/м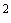 , но после реинфузии эритроцитов повысился до 64,6±20,05 мл/м
, но после реинфузии эритроцитов повысился до 64,6±20,05 мл/м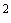 . Колебания индекса доставки кислорода (DО2I) в течение всей процедуры аутодонорского плазмафереза равномерны и незначительны.
. Колебания индекса доставки кислорода (DО2I) в течение всей процедуры аутодонорского плазмафереза равномерны и незначительны.
У беременных с гипокинетическим типом кровообращения во время эксфузии крови отмечалось кратковременное снижение сердечного индекса на 16% и индекса доставки кислорода на 13%. Однако, индекс доставки кислорода (DО2I) при этом остается в пределах нормативных значений за счет исходного высокого уровня гемоконцентрационных показателей крови, что свидетельствует об отсутствии условий для развития кислородной задолженности в организме беременной.
При аутодонорском плазмаферезе достоверных изменений состава периферической крови до и после заготовки аутоплазмы не выявлено, отмечается незначительное повышение содержания эритроцитов: до ПА - 3,88±0,15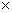 10
10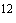 /л, после ПА - 3,96±0,13
/л, после ПА - 3,96±0,13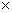 10
10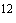 /л и уровня гемоглобина: до ПА - 119,92±1,31 г/л, после ПА - 120,48±1,48 г/л (р>0,05).
/л и уровня гемоглобина: до ПА - 119,92±1,31 г/л, после ПА - 120,48±1,48 г/л (р>0,05).
Особое внимание при проведении аутоплазмодонорства было уделено изучению состояния системы гемостаза. Доказано, что заготовка аутоплазмы у беременных должна проводиться проводилась* на фоне гиперкоагуляции. Во время аутодонорского плазмафереза у всех беременных отмечалась умеренная гиперкоагуляция которая соответствовала нормативным показателям: концентрация фибриногена -4,45±0,19 г/л, ПТИ - 102,37±1,04%, АЧТВ - 32,1±2,32 сек, РКМФ - отр., ИТП - 16,82±0,861 усл.ед., r+k=17,89±1,542 мм, mа - 48,06±0,772 мм. Перед родами у беременных не отмечалось повышения функциональной активности факторов свертывания: фибриноген - 4,93±0,18 г/л, ПТИ - 108,38±1,26%, АЧТВ - 32,8±1,92 сек, РКМФ - отр., ИТП - 14,01±0,772 усл.ед., r+k=21,5±2,031 мм, mа - 43,45±0,841 мм. У 11,53%о* пациенток по данным гемостазиограммы отмечается наличие продуктов паракоагуляции. После родов на фоне физиологической кровопотери показатели системы гемостаза соответствовали умеренной гиперкоагуляции: фибриноген - 4,48±0,221 г/л, ПТИ - 101,43±0,95%, АЧТВ - 33,1±1,64 сек, РКМФ - отр., ИТП - 15,59±0,931 усл.ед., r+k=17,2±1,23 мм, mа - 48,05±0,713 мм. Таким образом, применение аутоплазмых* во время родоразрешения способствовало стабилизации гемокоагуляционного потенциала, обеспечив минимальную кровопотерю.
_______________
* Текст документа соответствует оригиналу. - Примечание изготовителя базы данных.
Изучение влияния аутодонорского плазмафереза на состояние плода проводилось на основании данных кардиотокографического и допплерометрического исследований до и через 2 дня после процедуры аутоплазмодонорства у беременных женщин данной группы.
Допплерометрические исследования были проведены 30 беременным наблюдаемой группы. Проводилась регистрация спектров кривых скоростей кровотока левой и правой маточных артерий (маточно-плацентарный кровоток) и магистральных артерий плода - артерия пуповины, нисходящий отдел аорты, средней мозговой артерии (фето-плацентарный кровоток). Критерием нарушения кровотока в данных сосудах служило повышение индекса периферического сосудистого сопротивления более чем на 2 сигмальных отклонения по сравнению с нормой. До аутодонорского плазмафереза имело место снижение маточно-плацентарного кровотока при сохранном плодово-плацентарном кровотоке у 20% беременных. Сочетанное нарушение фето-плацентарного и маточно-плацентарного кровотока не отмечено у беременных наблюдаемой группы. У одной беременной отмечалось усиление кровотока в средне-мозговой артерии плода. У 76,6% беременных маточно-плацентарный и фето-плацентарный кровоток был в пределах нормы.
После аутодонорского плазмафереза снижение маточно-плацентарного кровотока отмечено уже у 13,3% женщин, у одной беременной сохранялось усиление кровотока в средне-мозговой артерии, у остальных беременных маточно-плацентарный и фето-плацентарный кровоток в пределах нормы.
Согласно данным антенатальной кардиотокографии, до заготовки аутоплазмы, у 23,3% беременных выявлены начальные признаки внутриутробного страдания плода. Показатель состояния плода (ПСП) колебался в пределах от 1,0 до 1,32 и в среднем составил 1,18±0,461. У 46,6% беременных по данным кардиотокографии отмечалось нормальное состояние плода с подозрением на патологию пуповины (1 или 2-х кратное обвитие) - ПСП находился в пределах 0,2 до 0,78 и в среднем составил 0,54±068. У 30% беременных (по данным КТГ, ПСП составлял 0,01±0,001. Выраженные нарушения состояния плода не зафиксированы ни у одной беременной. После проведения аутодонорского плазмафереза у беременных с начальными признаками внутриутробного страдания плода уровень ПСП снизился и в среднем составил 1,1±0,13, у остальных беременных, не имеющих признаков нарушения состояния плода, ПСП после заготовки аутоплазмы практически не изменился и составил 0,4±0,05. Отсутствует отрицательное влияние аутоплазмодонорства на маточно-плацентарное и фето-плацентарное кровообращение. Анализ состояния плода по данным допплерометрии и кардиотокографии до и после проведения аутоплазмодонорства свидетельствует об отсутствии отрицательного влияния на маточно- и фето-плацентарное кровообращение (С-3). Аутоплазмодонорство у беременных является эффективным методом кровесбережения при учете критериев заготовки и использования аутоплазмы на основе гемостазиологического мониторинга на всех этапах аутоплазмодонорства (С-3). Трансфузия аутоплазмы, заготовленной у беременных на фоне физиологической гиперкоагуляции, во время родоразрешения способствует минимизации кровопотери за счет корригирующего влияния на состояние системы гемостаза при проявлениях хронического ДВС-синдрома, нарушениях механизмов адаптации системы гемостаза перед родами, приводящих к снижению коагуляционной активности крови. Использование аутоплазмы позволяет в 2 раза снизить применение донорской плазмы, а в ряде случаев и полностью отказаться от ее использования (С-3).
Нормоволемическая гемодилюция с аутогемотрансфузией
Сущность методики управляемой нормоволемической гемодилюции заключается в заготовке цельной крови пациента непосредственно в операционной до начала хирургического вмешательства, с последующей трансфузией изъятой крови в конце операции. Применение данного метода позволяет сохранить глобулярный компонент крови и способствует быстрому восстановлению гематологических показателей в послеоперационном периоде. Смысл метода заключается в дозированном разведении крови гемодилютантом, который снижает вязкость крови и периферическое сопротивление, обеспечивает полноценную кислородно-транспортную функцию крови с сохранением цитохимических структур эритроцитов, приводя к повышению сердечного выброса и ударного объема, что сопровождается улучшением микроциркуляции и органного кровотока. Особенно важно то, что проведение операции при пониженных цифрах Нb и Ht уменьшает абсолютное количество теряемых в ходе операции эритроцитов. Так при снижении гематокрита до 25% с последующим возмещением кровопотери аутокровью предотвращается потеря половины эритроцитов. Кроме того, трансфузия заготовленной аутокрови в послеоперационном периоде способствует восполнению глобулярного компонента крови, позволяет отказаться от применения донорских эритроцитов, и, следовательно, избежать гемотрансфузионных и инфекционных осложнений [15].
Данная методика проста в исполнении, не требует специально обученного персонала и сложного оборудования и, что очень важно, экономически выгодна, что позволяет рекомендовать ее для широкого применения в акушерские стационары любого уровня.
Показания для проведения нормоволемической гемодилюции с аутогемотрансфузией
Абдоминальное родоразрешение у беременных группы риска по развитию кровотечения (предполагаемая кровопотеря более 20% объема циркулирующей крови) - рубец на матке после предыдущих операций кесарево сечение, многоплодие, беременность после программы ЭКО и ПЭ, наличие хронической формы ДВС синдрома, расширение объема операций, сочетанные показания к операции КС.
Беременные с высоким риском по развитию гемотрансфузионных осложнений. Беременные с редкими группами крови при отказе пациентки от переливания донорских компонентов крови.
Противопоказания для проведения нормоволемической гемодилюции с аутогемотрансфузией
Гипотония - систолическое АД ниже 90 мм. рт.ст., диастолическое АД ниже 60 мм. рт.ст.
Анемия - Нв<90 г/л, Ht<30%
Тромбоцитопения (<150 10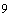 /л)
/л)
Гипопротеинемия - общий белок <60 г/л, альбумин <35 г/л
Тяжелая экстрагенитальная патология (недостаточность кровообращения 2-3 ст., легочная недостаточность, тяжелая почечная патология, выраженная гипертензия, цирроз печени, эпилепсия
Преэклампсия тяжелой степени
Острые инфекционные заболевания
Онкологические заболевания
Заболевания крови
Материально-техническое обеспечение проведения нормоволемической гемодилюции с аутогемотрансфузией технологии
1. Инфузионный коллоидный раствор гидроксиэтилированного крахмала (ГЭК 10%, 200/0,5) 500 мл.
2. Система контейнеров для сбора, фракционирования и хранения крови типа 500/300.
Методика проведения нормоволемической гемодилюции с аутогемотрансфузией
Методика нормоволемической гемодилюции заключается в заготовке цельной крови пациента непосредственно в операционной, с последующей трансфузией изъятой крови в конце операции по достижению хирургического гемостаза.
Процедуру выполняют на операционном столе после введения пациентки в наркоз.
1. Предварительно в кубитальную вену осуществляется инфузия 250 мл 10% (6%) гидроксиэтилированного крахмала (ГЭК 200/0,5). Выбор 6% или 10% раствора ГЭК производится в зависимости от данных коагулограммы: при изокоагуляции и умеренной гирперкоагуляции предпочтение отдается 6% раствору, при выраженной гиперкоагуляции - 10% раствору ГЭК.
2. Производится пункция коллатеральной кубитальной вены и эксфузия крови в стандартные пластиковые контейнеры, под постоянным контролем АД, ЧСС, Ht, ЦВД.
Объем извлекаемой крови может быть рассчитан по формуле Malcolm D. (1991):
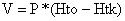
где 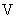 - объем извлекаемой крови в мл,
- объем извлекаемой крови в мл, 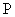 - масса тела пациентки в кг *70 (средний объем крови человека 70 мл/кг),
- масса тела пациентки в кг *70 (средний объем крови человека 70 мл/кг), 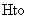 - гематокрит исходный в л/л,
- гематокрит исходный в л/л, 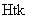 - гематокрит конечный в л/л.
- гематокрит конечный в л/л.
3. По окончанию эксфузии крови, осуществляется введение еще 250 мл 10% (6%) ГЭК 200/0,5.
4. Контейнеры с заготовленной аутокровью обязательно маркируют и хранят в операционной при комнатной температуре.
5. В конце операции, по достижению хирургического гемостаза, проводится реинфузия заготовленной аутокрови.
Возможные осложнения, их профилактика и купирование
1. Аллергические реакции на консервант, раствор гидроксиэтилированного крахмала (проводится десенсибилизирующая терапия).
2. Синдром "нижней полой вены" (с целью купирования данного синдрома изменяют положение беременной на операционном столе, укладывая ее в положение "на боку").
3. Гипотония (необходимо остановить эксфузию крови, с целью коррекции АД проводят инфузию коллоидных и кристаллоидных растворов).
Контролируемые лабораторные параметры при проведении нормоволемической гемодилюции:
-
1. Артериальное давление, пульс;
-
2. Уровень гемоглобина, гематокрита, эритроцитов, тромбоцитов;
-
3. Гемостазиограмма.
Эффективность проведения нормоволемической гемодилюции с аутогемотрансфузией
Нормоволемическая гемодилюция с аутогемотрансфузией рекомендуется для женщин, у которых предполагается интраоперационная кровопотеря до 25% ОЦК (С-3).
Нормоволемическая гемодилюция с аутогемотрансфузией должна выполняться только квалифицированным персоналом, регулярно ее проводящим и имеющим необходимые знания и опыт. Должно быть получено согласие пациента на нормоволемическую гемодилюцию (С-3).
Нормоволемическая гемодилюция с аутогемотрансфузией в акушерских стационарах должна быть предметом аудита и мониторинга (С-3) [1, 15, 42].
Результаты проведения нормоволемической гемодилюции с аутогемотрансфузией при операции кесарева сечения
Таблица 1
|
Характеристика Группы исследования |
Результаты исследований |
Выводы |
|
240 беременных, которым в начале операции кесарева сечения с целью уменьшения потери эритроцитов была проведена нормоволемическая гемодилюция (НГ) с последующей интраоперационной аутогемотрансфузией. |
Центральная и периферическая гемодинамика - показано снижение ИОПСС после проведения НГ на 33% по сравнению с исходным значением. Достоверное увеличение сердечного индекса (СИ) на 37%, и ударного индекса (УИ) на 30%. Достоверное увеличение систолического АД до 130,2±2,5 мм. рт.ст. САД достоверно снизилось до 90,1±2,3, ЧСС участилось но осталось в пределах нормы и равнялось 84,8±2,1 уд/мин. По окончании кесарева сечения существенных изменений параметров гемодинамики не происходит. К 5-м суткам послеоперационного периода - возвращение параметров гемодинамики к исходным показателям. |
Нормоволемическая гемодилюция аутогемотрансфузией позволяет на время проведения операции улучшить объемные показатели кровотока, уменьшить сосудистый спазм и кислородную емкость крови, последнее приводит к снижению САД, в результате чего происходит увеличение венозного возврата, что выражается в увеличении УИ и СИ на фоне стабильной ЧСС. Приведенные данные свидетельствуют о стабильности параметров кровообращения на фоне проведения нормоволемической гемодилюции с аутогемотрансфузией при операции кесарева сечения. Все изменения показателей центральной и периферической гемодинамики не выходили за пределы нормы и по сути отражали компенсаторно-приспособительные реакции организма направленные на улучшение микроциркуляции и увеличение оксигенации тканей. (С-3) |
|
Показания к абдоминальному родоразрешению - рубец на матке после предыдущих операций кесарева сечения 40% и сочетанные показания 37,5%. Кормление грудью |
Показатели периферической крови - после проведения эксфузии крови выявлено достоверное снижение гематокрита с 0,37±0,05 до 0,30±0,04 л/л, что составило 23%. Уровень гемоглобина достоверно уменьшился на 17%: с 122,2±4,3 до 104,2±3,5 г/л, а эритроциты на 18%: с 3,81±0,18 до 3,21±0,13 |
Эти изменения отражают состояние гемодилюции, уменьшение вязкости крови, улучшение ее реологических свойств. Следует отметить, что все изменения, вызванные эксфузией, находились в безопасных пределах и с учетом данных о наличии в крови трехкратного резерва кислородной емкости, не представляли опасности для беременной и внутриутробного плода. Нормоволемическая гемодилюция с последующей интраоперационной аутогемотрансфузией в объеме 5-10 мл/кг от массы тела не вызывает выраженных изменений показателей периферической крови родильниц в послеоперационном периоде. Аутогемотрансфузия резервированной в начале операции крови позволяет полноценно восполнить значительную часть общей операционной кровопотери и тем самым предупредить развитие дестабилизации кровообращения и гипоксии. (С-3) |
|
Объем кровопотери в группе колебался от 600 до 900 мл и в среднем составил 705,51±115 мл. Объем реинфузированной аутокрови колебался от 450 до 600 мл и в среднем составил 522,06±51,75 мл. |
Система гемостаза У всех пациенток показатели тромбоэластограммы до операции соответствовали умеренной гиперкоагуляции характерной для III триместра беременности. У 8 (20%) обследованных женщин выявлена активация внутрисосудистого свертывания крови, проявляющийся наличием в плазме высокомолекулярных растворимых фибрин-мономерных комплексов (РКМФ). На первые сутки послеоперационного периода у родильниц происходило достоверное снижение уровня фибриногена, а к 5-м суткам достоверное его увеличение. |
Под влиянием нормоволемической гемодилюции происходило незначительное снижение коагуляционного потенциала крови, которое не представляло угрозы в плане развития кровотечения. По окончании операции состояние гиперкоагуляции сохранялось. Это связано, во-первых, с трансфузией свежей аутокрови, во-вторых, с меньшим потреблением факторов свертывания за счет разведения при гемодилюции. В послеоперационном периоде состояние системы гемостаза характеризовалось умеренной гиперкоагуляцией, свойственной для послеоперационного периода. (С-3) |
|
КОС и газы крови: У пациенток после проведения нормоволемической гемодилюции с аутогемотрансфузией достоверных изменений значений КОС после операции не выявлено. В динамике параметров кислородного баланса отмечалось снижение |
При нормоволемической гемодилюции с аутогемотрансфузией отмечается достаточное обеспечение тканей кислородом, что подтверждает безопасность и эффективность данного метода кровесбережения. (С-3) |
|
|
Послеоперационный койко-день у женщин, которым во время операции кесарева сечения была выполнена нормоволемическая гемодилюция в среднем составил, 7,4±0,5 дня, что достоверно ниже среднего показателя в стационаре 9,3±0,3. Необходимо проведение больших исследований |
Проведение нормоволемической гемодилюции с аутогемотрансфузией при абдоминальном родоразрешении, позволяет обеспечить адекватное восполнение операционной кровопотери у беременных группы высокого риска по развитию кровотечения, благоприятное течение послеоперационного периода и не оказывает отрицательного влияния на новорожденного (С-3) |
Интраоперационная реинфузия аутоэритроцитов
Методика интраоперационной реинфузии аутоэритоцитов с использованием современных аппаратов типа* является одним из наиболее эффективных методов кровесбережения во время операции. Специалистами нашего Центра впервые в мире данная методика предложена для применения в акушерстве.
________________
* Текст документа соответствует оригиналу. - Примечание изготовителя базы данных.
Методика обеспечивает сбор теряемой крови из операционной раны, отмывание эритроцитов в центрифуге и возврат эритровзвеси в сосудистое русло пациентки при проведении родоразрешающих операций (кесарево сечение, кесарево сечение с консервативной миомэктомией, кесарево сечение с последующей ампутацией или экстирпацией.
Показания к проведению интраоперационной реинфузии эритроцитов при абдоминальном родоразрешении:
-
1. предлежание и преждевременная отслойка нормально расположенной плаценты;
-
2. врожденные и приобретенные дефекты системы гемостаза;
-
3. многоплодная беременность;
-
4. спаечный процесс в брюшной полости;
-
5. варикозное расширение вен матки;
-
6. гемангиомы органов малого таза;
-
7. миома, аномалии развития матки;
-
8. разрыв матки;
-
9. расширение объема оперативного вмешательства.
Противопоказания к проведению интраоперационной реинфузии аутоэритроцитов в акушерстве
Абсолютные
- наличие в брюшной полости гнойного содержимого;
- наличие в брюшной полости кишечного содержимого;
- наличие в излившейся крови веществ, противопоказанных к введению в сосудистое русло (перекись водорода, дистиллированная вода, гемостатические препараты на основе коллагена и др.).
Относительные
- наличие у больной злокачественного новообразования.
До недавнего времени проведение интраоперационной реинфузии во время операций по удалению злокачественных опухолей считалось абсолютно противопоказанным, ввиду высокого риска гематогенной диссеминации опухолевых клеток. Разрабатываются и внедряются эффективные методы очистки полученной аутоэритромассы от лейкоцитов и опухолевых клеток. Одним из таких способов является инфузия эритроконцентрата через лейкоцитарный фильтр.
Материально-техническое обеспечение
1. Аппарат для аутотрансфузий, а также наборы одноразовых магистралей к ним. Данные аппараты могут работать как в ручном, так и в автоматическом режимах. Однако наивысшее качество получаемой аутоэритроцитарной взвеси гарантирует работа в автоматическом режиме.
2. Раствор натрия хлорида изотонический физиологический (раствор NaCl 0,9%) 200 мл или 400 мл, пластиковый контейнер 500 мл или 1000 мл.
3. Антикоагулянт.
4. Фильтр медицинский лейкоцитарный.
Технология использования метода
Принцип процедуры заключается в аспирации из операционной раны излившейся крови, обработке ее в аппарате и последующей реинфузии полученной аутоэритроцитарной взвеси (Ht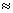 60%) обратно в сосудистое русло пациентки.
60%) обратно в сосудистое русло пациентки.
Заправка одноразовых магистралей проводится в операционной до начала операции. Стерильный отсос передается операционной сестре.
Сбор излившейся в рану крови проводится вторым ассистентом. Отрицательное давление, создаваемое вакуум-аспиратором, не должно превышать 100 мм рт.ст.
Кровь, аспирируемая из раны, смешивается с раствором антикоагулянта, проходит сквозь фильтр, задерживающий частицы тканей, сгустки крови и собирается в резервуар. Когда объем собранной крови станет адекватным объему резервуара начинается первая фаза работы аппарата - заполнение промывочной чаши (колокола).
Данная фаза состоит из нескольких этапов:
-
1. Разгон центрифуги до 5600 об/мин.
-
2. Перенос крови из резервуара в промывочный колокол с помощью перистальтического насоса, начало процесса центрифугирования.
-
3. Наполнение промывочного колокола продолжается до тех пор, пока эритроциты не заполнят весь объем колокола (объем колокола может быть 125 мл, 175 мл, 225 мл). Отделяющаяся в процессе центрифугирования плазма, удаляется вместе с антикоагулянтом в соответствующую емкость. После этого в автоматическом или ручном режиме начинается вторая фаза - отмывание эритроцитов в стерильном физиологическом растворе 0,9% NaCl.
Отмывание продолжается до тех пор, пока заданный объем промывающего раствора (в акушерстве 1000-1500 мл) не будет полностью проведен через эритроциты. Все это время происходит центрифугирование.
Заключительная фаза работы аппарата - опустошение колокола:
-
1. Центрифуга останавливается и перистальтический насос начинает вращение в обратном направлении.
-
2. Эритроцитарная взвесь переводится из промывочного колокола в мешок для реинфузии.
Далее процесс повторяется до тех пор, пока не будет обработана вся аспирированная из раны кровь. Продолжительность первого описанного цикла составляет - 3-5 минут.
Во время работы на дисплее аппарата четко отражены все необходимые параметры: скорость вращения центрифуги, скорость вращения насоса, количество перенесенного раствора. После каждого цикла работы высвечивается количество собранных и отмытых эритроцитов.
Реинфузия эритровзвеси должна осуществляться с использованием лейкоцитарного фильтра.
Возможные осложнения, их профилактика и купирование
При операции кесарево сечение необходимо помнить о наличии тромбопластических субстанций в околоплодных водах и возможности их переноса в сосудистое русло пациентки. Потому, по нашему мнению, перед операцией у беременной целесообразно произвести амниотомию, использовать второй насос непосредственно после извлечения плода для аспирации околоплодных вод, сыровидной смазки и мекония. После этого можно пользоваться насосом для сбора и реинфузии. Кроме того, в конструкции аппарата предусмотрена возможность увеличения количества физиологического раствора, используемого для отмывания эритроцитов.
Контролируемые лабораторные параметры: Уровень гемоглобина, гематокрита, эритроцитов, тромбоцитов; гемостазиограмма перед операцией, во время кровотечения, в послеоперационном периоде; время образование сгустка по Ли-Уайту; биохимические параметры: общий белок, билирубин, креатинин, мочевина, калий, натрий, хлор. Общий анализ мочи.
Эффективность использования метода
ИРА рекомендуется для женщин, у которых предполагается интраоперационная кровопотеря более 20% ОЦК (С-3).
ИРА должна выполняться только квалифицированным персоналом, регулярно ее проводящим и имеющим необходимые знания и опыт. Должно быть получено согласие пациента на проведение ИРА. Использование ИРА в акушерских стационарах должно быть предметом аудита и мониторинга [9, 20, 25, 36, 42, 43].
Качество реинфузируемых аутоэритроцитов
Изучение срока жизни отмытых эритроцитов показало, что он равен обычным эритроцитам. Отмывание эритроцитов существенно снижает уровень свободного гемоглобина, уменьшая тем самым риск возможной нефротоксичности реинфузируемых аутоэритроцитов. Реинфузируемая кровь не депонируется, а наиболее полноценно включается в русло циркуляции.
Доказательством безопасности применения реинфузии в акушерстве служат результаты электронно-микроскопического исследования получаемой суспензии эритроцитов: реинфузируемая жидкость представляет собой практически на 100% чистую суспензию эритроцитов (С-3).
Клиническая эффективность метода изучена более чем у 1000 беременных, которым во время операции кесарева сечения, с целью возмещения кровопотери аутоэритроцитами, проводилась интраоперационная реинфузия.
Наиболее частыми показаниями к абдоминальному родоразрешению явились: миома матки - 40% и рубец на матке после предыдущих операций кесарева сечения - 18,6%. Данный факт объясняется тем, что эти беременные входят в группу высокого риска по развитию кровотечения. Третьим по частоте показанием для абдоминального родоразрешения и интраоперационной реинфузии аутокрови стала беременность, наступившая в результате ЭКО и ПЭ (15%). Интересным представляется то, что в данной категории у половины беременных реинфузия была выполнена по их настоятельному желанию. Это обстоятельство связано с категорическим отказом этих женщин от использования донорских эритроцитов в случае возникновения у них кровотечения.
Доля экстренного родоразрешения составила в группе 27,8%. К экстренным показаниям относятся отслойка нормально расположенной плаценты, несостоятельность рубца на матке, тяжелый гестоз. В остальных случаях операция кесарево сечение была произведена в экстренном порядке у женщин, готовящихся на плановое абдоминальное родоразрешение в связи с началом родовой деятельности или с преждевременным излитием околоплодных вод.
Средняя продолжительность оперативного вмешательства составила 65,5±5,12 мин.
Объем кровопотери в группе колебался от 700 до 3100 мл и в среднем составил 1460,51±115,32 мл. Объем реинфузированных аутоэритроцитов колебался от 250 до 1560 мл и в среднем составил 644,79±64,42 мл.
Нами было изучено влияние интраоперационной реинфузии аутоэритроцитов на состояние показателей периферической крови, в частности так называемой "красной крови" в зависимости от уровня кровопотери. В исходных показателях состава периферической крови достоверных различий не выявлено, уровень гемоглобина (Нb) в среднем составил 123,25±2,14 г/л, гематокрита (Ht) - 0,36±0,04 л/л, эритроцитов 4,01±0,31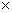 10
10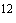 /л.
/л.
При сравнении уровней гемоглобина, гематокрита и количества эритроцитов в послеоперационном периоде выявлено достоверное снижение данных показателей на первые сутки после операции, так уровень Нb в среднем составил 110,00±7,62 г/л, Ht - 0,30±0,03 л/л, эритроцитов 3,60±0,32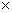 10
10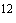 /л.
/л.
Необходимо отметить, что к 5-м суткам послеоперационного периода происходит достоверное увеличение уровня гемоглобина, гематокрита и эритроцитов до исходных показателей (Нb - 120,15±2,62 г/л, Ht - 0,39±0,01 л/л, эритроцитов 3,95±0,28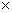 10
10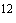 /л.
/л.
Представляет интерес динамика содержания тромбоцитов. На 1-е сутки происходит достоверное снижение уровня тромбоцитов (до операции 215,08±22,26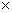 10
10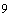 /л после 195,42±6,27
/л после 195,42±6,27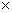 10
10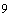 /л), что свидетельствует о массивности и тяжести кровопотери. К 5-м суткам послеоперационного периода происходит достоверное увеличение количества тромбоцитов (232,08±39,55
/л), что свидетельствует о массивности и тяжести кровопотери. К 5-м суткам послеоперационного периода происходит достоверное увеличение количества тромбоцитов (232,08±39,55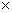 10
10 /л), причем не только по отношению к показателям на 1-е сутки после операции, но и по отношению к данным до оперативного вмешательства.
/л), причем не только по отношению к показателям на 1-е сутки после операции, но и по отношению к данным до оперативного вмешательства.
Повышенный интерес представляло изучение системы гемостаза в подгруппах. Показатели тромбоэластограммы до операции соответствовали физиологическим адаптационным изменениям системы гемостаза, характерным для III триместра беременности, то есть - гиперкоагуляции.
У всех женщин выявлен высокий процент активации внутрисосудистого свертывания крови, проявляющийся наличием в плазме высокомолекулярных растворимых фибрин-мономерных комплексов (РКМФ), являющихся маркерами ДВС-синдрома, данный показатель составил 90%.
На первые сутки послеоперационного периода происходит достоверное снижение уровня фибриногена, а к 5-м суткам достоверное его увеличение. Что касается показателей тромбоэластограммы, то достоверно изменяется только r+k. На первые сутки происходит его увеличение, а на 5-е достоверное снижение до нормативных показателей.
Особый интерес представляет динамика изменения РКМФ в плазме крови. Так на первые сутки после операции данный показатель достоверно увеличился и стал положительным 100% пациенток соответственно. К пятым суткам происходит достоверное снижение количества пациенток, в плазме крови у которых определяется РКМФ до 31%.
Таким образом, проведенное исследование наглядно показало, что у всех женщин состояние системы гемостаза характеризуется структурной и хронометрической гиперкоагулюцией, протекающей у большинства по типу хронической формы ДВС-синдрома.
Анализ течения послеродового периода у пациенток исследуемых подгрупп показал, что наиболее частым осложнением послеродового периода была анемия. Анемия легкой степени выявлена у 3,5% родильниц, средней степени у 6,25% пациенток, а анемия тяжелой степени не выявлена ни в одном случае (С-3).
Анализ продолжительности пребывания пациенток в стационаре показал, что в среднем послеоперационный койко-день составил 8,2±0,2, что в 1,5 раза ниже, чем у пациенток, которым данный метод не применялся.
Таким образом, применение интраоперационной реинфузии аутоэритроцитов позволяет минимизировать использование донорских компонентов крови при кровопотере любого объема и избежать синдрома массивной гемотрансфузии, а также значительно улучшает течение послеоперационного периода и сокращает сроки пребывание больных в стационаре (В-2b).
ВАЖНО: В соответствии с Федеральным законом от 20.07.2012 г. N 125-ФЗ (ред. от 25.11.2013) "О донорстве крови и ее компонентов" беременные женщины, участвующие в программах аутодонорства не могут являться донорами крови для других лиц, то компоненты аутокрови, полученные от них, могут быть использованы только для аутотрансфузии. Согласно техническому регламенту, утвержденному постановлением Правительства Российской Федерации от 26.01.2010 г. N 29 "Об утверждении технического регламента о требованиях безопасности крови, ее продуктов, кровезаменяющих растворов и технических средств, используемых в трансфузионно-инфузионной терапии", неиспользованные аутокомпоненты крови подлежат обязательной утилизации.
|
Президент Российского общества акушеров-гинекологов |
В.Н.Серов |
Согласовано:
|
Главный внештатный специалист |
Л.В.Адамян |
Приложение N 1
Классификация уровней достоверности и доказательности рекомендаций
Таблица 2
|
Уровни доказательств |
Описание |
|
1а |
Мета-анализы высокого качества, систематические обзоры рандомизированных контролируемых исследований (РКИ), или РКИ с очень низким риском систематических ошибок |
|
1b |
Мета-анализы, систематические, или РКИ с высоким риском систематических ошибок |
|
2а |
Высококачественные систематические обзоры исследований случай-контроль или когортных исследований. Высококачественные обзоры исследований случай-контроль или когортных исследований с очень низким риском эффектов смешивания или систематических ошибок и средней вероятностью причинной взаимосвязи |
|
2b |
Хорошо проведенные исследования случай-контроль или когортные исследования со средним риском эффектов смешивания или систематических ошибок и средней вероятностью причинной взаимосвязи Исследования случай-контроль или когортные исследования с высоким риском эффектов смешивания или систематических ошибок и средней вероятностью причинной взаимосвязи |
|
3 |
Не аналитические исследования (например: описания случаев, серий случаев) |
|
4 |
Мнение экспертов |
Надежность клинических рекомендаций: градации по качеству
|
A |
Рекомендации основываются на качественных и надежных научных доказательствах |
|
B |
Рекомендации основываются на ограниченных или слабых научных доказательствах |
|
C |
Рекомендации основываются главным образом на согласованном мнении экспертов, клиническом опыте |
Приложение N 2
Образец этикетки
Наименование учреждения здравоохранения
|
АУТОПЛАЗМА |
||||||||||||||
|
N кроводачи |
||||||||||||||
|
ФИО |
||||||||||||||
|
N и/р |
Дата рождения |
|||||||||||||
|
Гр. Крови, Rh |
||||||||||||||
|
Дата заготовки |
||||||||||||||
|
Количество |
мл |
|||||||||||||
|
изг. из |
мл |
|||||||||||||
|
конс. |
кол-во |
|||||||||||||
|
Дата заготовки |
||||||||||||||
|
Врач: |
||||||||||||||
|
Хранить при t ниже -25°С 36 месяцев Использовать в течение 30 мин после размораживания. Повторно не замораживать |
||||||||||||||
Приложение N 3
ПРОТОКОЛ ИНТРАОПЕРАЦИОННОЙ РЕИНФУЗИИ КРОВИ |
|||||||||||||||||||||||||||||||||||||||||
|
Фамилия, И., О. женщины |
|||||||||||||||||||||||||||||||||||||||||
|
N ист. Болезни, родов |
Дата операции |
||||||||||||||||||||||||||||||||||||||||
|
Клинический диагноз |
|||||||||||||||||||||||||||||||||||||||||
|
Хирургический диагноз |
|||||||||||||||||||||||||||||||||||||||||
|
Кровопотеря во время операции |
Общая кровопотеря |
||||||||||||||||||||||||||||||||||||||||
|
Название аппарата для реинфузии |
|||||||||||||||||||||||||||||||||||||||||
|
Объем израсходованного физиологического раствора |
|||||||||||||||||||||||||||||||||||||||||
|
Объем собранных эритроцитов |
Из них перелито |
||||||||||||||||||||||||||||||||||||||||
|
Реакция на реинфузию |
|||||||||||||||||||||||||||||||||||||||||
|
Гемотрансфузия донорской эр. массы |
|||||||||||||||||||||||||||||||||||||||||
|
Трансфузия донорской плазмы |
|||||||||||||||||||||||||||||||||||||||||
|
Показатели гомеостаза: до операции / 1-е сутки \ 3-и сутки |
|||||||||||||||||||||||||||||||||||||||||
|
НВ |
\ |
\ |
г/л |
Ht |
\ |
\ |
л/л |
Эр. |
\ |
\ |
|||||||||||||||||||||||||||||||
|
Общий белок |
\ |
\ |
г/л |
Общий билирубин |
\ |
\ |
мкмоль/л |
||||||||||||||||||||||||||||||||||
|
ИТП тромбоэластограммы |
\ |
\ |
у.е. |
||||||||||||||||||||||||||||||||||||||
|
Подпись врача, проводившего реинфузию |
|||||||||||||||||||||||||||||||||||||||||
Список литературы
1. Абубакирова A.M., Кулаков В.И., Баранов И.И. "Аутодонорство в акушерстве и гинекологии". / Акуш.-гинекология. 1996, N 2, с.6-7.
2. Бурлев В.А., Коноводова Е.Н., Орджоникидзе Н.В. и др. Лечение латентного дефицита железа и железодефицитной анемии у беременных. // Российский вестник акушера-гинеколога. - 2006. - N 1. - С.64-68.
3. Воробьев А.И., Городецкий В.М., Краснопольский В.И. Трансфузиологическая помощь при лечении острой массивной кровопотери у родильниц. Методические рекомендации. М. 2000.
4. Жибурт Е.Б. Безопасное переливание крови. - СПб: Издательство "Питер", 2000 - 320 с.
5. Зильбер А.П. Взлет и падение гемотрансфузии: исторический анализ в период, переходный к эпохе бескровной хирургии. / Бескровная хирургия, итоги и перспективы. М., 2002, с.10-17.
6. Интенсивная терапия в акушерстве и гинекологии (эфферентные методы). / Кулаков В.И., Серов В.Н., Абубакирова A.M., Федорова Т.А. // М., 1998, 206 с.
7. Колесниченко А.П., Грищак Г.В. "Особенности этиопатогенеза, диагностики и интенсивной терапии ДВС-синдрома при критических состояниях в акушерско-гинекологической практике" Методические рекомендации. Красноярск, 2001, с.51.
8. Константинов Б.А., Рагимов А.А., Дадвани С.А. Трансфузиология в хирургии. М., 2000, 528 с.
9. Кулаков В.И., Серов В.Н., Абубакирова A.M. Клиническая трансфузиология в акушерстве, гинекологии и неонатологии // М. Триада-Х-2001 - 205 с.
10. Литманович К.Ю., Селиванов Е.А., Дуткевич И.Г. Проблемы безопасности и эффективности гемотрансфузионной терапии. "Эфферентная терапия" 2004 г., т.10, N 3, с.37-47.
11. Организация заготовки и применения аутологичной плазмы у беременных группы риска по кровотечению: методические рекомендации МЗ РФ N 2003/6 от 2003 г.
12. Организация трансфузионной терапии в лечебно-профилактических учреждениях: методические рекомендации (утв. Зам. Министра здравоохранения РСФСР Г.В.Сергеев 28.11.1986), МЗ РСФСР, 1986 г., с.43.
13. Острая массивная кровопотеря. // Воробьев А.И., Городецкий В.М., Шулутко Е.М., Васильев С.А. / Москва, ГЭОТАР-МЕД, 2001, 175 с.
14. Чанчиев З.М., Чаленко В.В. Переливание крови в историческом аспекте.// Гематология и трансфузиология, 2003 г., т.48, N 1, с.31-35
15. Шейкина Т.В. Острая нормоволемическая гемодилюция с аутогемотрансфузией при абдоминальном родоразрешении /. Автореф. Дисс. канд. Мед. наук. 2011. 25 с.
16. Arnold D.L., Williams M.A., Miller R.S., Qiu С., Sorensen Т.K. Maternal iron deficiency anaemia is associated with an increased risk of abruption placentae - a retrospective case control study. J. Obstetr. Gynaecol. Res. 2009; 35: 446-452.
17. Beard J.L. Why iron deficiency is important in infant development. J. Nutr. 2008; 138: 2534-2536.
18. Beez M.G.: Hydroxyethyylstarch: a new plasmasubstitute for management of hypovolemia and shock. // Int.Rev. Amed Fors Med Serv., - 1994, v.7/8/9, - p.223.
19. Blajchman M.A., Vamvakas E.C. The Continuing Risk of Transfusion-Transmitted Infections. N Engel J Med 2006; 355: 1303-5.
20. BLOOD TRANSFUSION IN OBSTETRICS RCOG Green-top Guideline No. 47, December 2007, Minor revisions July 2008.
21. Bonnar J. Massive obstetric haemorrhageV/Baillieres Best Pract Res Clin Obstet Gynaecol. 2000 Feb; 14(l):l-18.
22. Bothwell T.H. Iron requirements in pregnancy and strategies to meet them. Am. J. Clin. Nutr. 2000; 72 (1 suppl.): 257S-264S.
23. Breymann Ch. et al. Diagnosis and treatment of iron-deficiency anaemia during pregnancy and postpartum. Arch. Gynecol. Obstet. 2010; 282: 577-580.
24. Carless P.A., Henry D.A., Moxey A.J., O'Connell D., Brown T., Fergusson D.A. Cell salvage for minimising perioperative allogeneic blood transfusion (Review) Copyright  2010 The Cochrane Collaboration. Published by John Wiley & Sons, Ltd.
2010 The Cochrane Collaboration. Published by John Wiley & Sons, Ltd.
25. Catling S.J., Freites O., Krishnan S., Gibbs R. Clinical experience with cell salvage in obstetrics: 4 cases from one UK centre. Int J Obstet Anesthes. 2002; 11: 128-34.
26. Cogswell M.E., Parvanta I., Ickes L., Yip R., Brittenham G.M. Iron supplementation during pregnancy, anemia, and birthweight: a randomised controlled trial. Am. J. Clin. Nutr. 2003; 78: 773-781.
27. Colomer J., Colomer C., Gutierrez D., et al. Anaemia during pregnancy as a risk factor for infant iron deficiency: report from the Valencia Infant Anaemia Cohort (VIAC) study. Paediatric and Perinatal Epidemiol. 1990; 4: 196-204.
28. Ekiz E., Agaoglu L., Karakas Z., Gurel N., Yalcin I. The effect of iron deficiency anemia on the function of the immune system. Hem. J. 2005; 5: 579-583.
29. Gambling L., Lang C., McArdle H.J. Fetal regulation of iron transport during pregnancy. Am. J. Clin. Nutr. 2011; 94: 1903S-1907S.
30. Gozzard D. Whe is high-dose intravenous iron repletion needed? Assessing new treatment options. Drug Design. Development and Therapy. 2011; 5: 51-60. AGBI Guidelines for Obstetric Anaesthetic Services, Revised Edition 2005.
31. Haas J.D., Brownlie T. Iron deficiency and reduced work capacity: a critical review of the research to determine a causal relationship. J. Nutr. 2001; 131: 676S-690S.
32. Hallberg L. In: Foman S.J., Zlotkin S., eds. Nutritional anemias. New York: Raven Press; 1992: 13-28.
33. Higgins S. Obstetric haemorrhage. // Emerg Med (Fremantle). 2003 Jun; 5(3): 227-231.
34. Johnson-Wimbley T.D., Graham D.Y. Diagnosis and management of iron deficiency anemia in the 21st century. // Therap. Adv. Gastroenterol. - 2011. - Vol. 4(3). - P.177-84.
35. Insel B.J., Schaefer C.A., McKeague I.W., Susser E.S., Brown A.S. Maternal iron deficiency and the risk of schizophrenia in offspring. Arch. Gen. Psychiatry. 2008; 65: 1136-1144.
36. Intra-operative blood cell salvage in obstetrics. National Institute for Health and Clinical Excellence, November 2005, Minor maintenance 22 January 2012.
37. Lyseng-Williamson K.A., Keating G.M. Ferric caroboxymaltose: a review of its use in iron-deficiency anaemia. Drugs. 2009; 69: 739-756.
38. Milman N. Prepartum anemia: Prevention and treatment. Ann. Hematol. 2008; Dec 87: 949-959.
39. Pahlavan P., Nezhat C., Nezhat C. Hemorrhage in obstetrics and gynecology. // Curr Opin Obstet Gynecol. 2001 Aug; 13(4): 419-24.
40. Perez E.M., Hendricks M.K., Beard J.L., et al. Mother-infant Interactions and infant development are altered by maternal iron deficiency anemia. J. Nutr. 2005; 135: 850-855.
41. Prevention and management of post-partum haemorrhage, RCOG Green-top Guideline 2009; 52: 1-24.
42. Prowse C.V. / Alternaftives to human blood and blood resources. // Vox Sang. - 1998. - Vol.74, N 2 - P-21-28.
43. Reiner D.S., Tortolani A.J. Postoperative peritoneal blood salvage with autotransfusion after hepatic trauma. // Surg Gynecol Obstet 1991; 173(1): 501-4.
44. Reveiz L., Gyte GML., Cuervo L.G., Casasbuenas A. Treatments for iron-deficiency anaemia in pregnancy (Review). Cochrane library; 2011.
45. Reyal F., Sibony O., Oury J.F., Luton D., Bang J., Blot P. Criteria for transfusion in severe postpartum hemorrhage: analysis of practice and risk factors. // Eur J Obstet Gynecol Reprod Biol. 2004 Jan 15; 112(1): 61-4.
46. Saa P., Castilla J., Presymptomatic detection of prions in blood. Science 2006; 313: 92-4.
47. Scholl Т.О., Hediger M.L. Anemia and iron-deficiency anemia: compilation of data on pregnancy outcome. Am. J. Clin. Nutr. 1994; 59: S492-S501.
48. Selo-Ojeme D.O. Primary postpartum haemorrhage. // J Obstet Gynaecol. 2002 Sep; 22(5): 463-9.
49. Tapiero H., Gate' L., Tew, K.D. Iron: deficiencies and requirements. Biomedicine and Pharmacotherapy. 2001; 55: 324-332.
50. Van den Broek N.R., Letsky E.A., White S.A., Shenkin A. Iron status in pregnant women: which measurements are valid? Br.J.Haem. 1998; 103: 817-824.
51. Wise V.С. Challenges of major obstetric haemorrhage. Best Practice Research Clinical Obstetrics and Gynaecology. 2010; 24: 353-365.
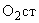 на 16%, но при этом эффективный транспорт кислорода, Sat
на 16%, но при этом эффективный транспорт кислорода, Sat 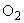 и парциальное напряжение кислорода в крови не претерпевали существенных изменений. В послеоперационном периоде параметры КОС и газы крови находились в пределах нормативных значений.
и парциальное напряжение кислорода в крови не претерпевали существенных изменений. В послеоперационном периоде параметры КОС и газы крови находились в пределах нормативных значений.