Инструкция по определению рибофлавина (витамина В(2)) в пищевых продуктах
ИНСТРУКЦИЯ
по определению рибофлавина (витамина В ) в пищевых продуктах
) в пищевых продуктах
РАЗРАБОТАНА в Институте питания АМН СССР лабораторией Витаминизации пищевых продуктов.
УТВЕРЖДЕНА Зам. начальника Главного Санитарно-эпидемиологического Управления Минздрава СССР Заиченко А.И. 10 июля 1987 г. N 4398-87
Для определения общего содержания рибофлавина в пищевых продуктах используют флюорометрический метод, разработанный в двух вариантах (прямой флюорометрии и люмифлавиновый). Он прошел широкую апробацию в различных лабораториях научных и практических учреждений, принимавших участие в подготовке справочных "Таблиц химического состава продуктов", рекомендован Междуведомственной комиссией по составлению этих таблиц и одобрен Минздравом СССР.
Принцип метода
Метод основан на свойстве свободного рибофлавина и продукта его фотолиза-люмифлавина - флюоресцировать при облучении их растворов светом с длиной волны 440-450 нм. В варианте прямой флюорометрии интенсивность флюоресценции измеряется до и после восстановления рибофлавина гидросернистокислым натрием. В люмифлавиновом варианте используется свойство рибофлавина при облучении в щелочной среде переходить в люмифлавин, интенсивность флюоресценции которого измеряют после извлечения его хлороформом.
Оборудование
Флюориметр ЭФ-3М или ФМ-Ц-2; потенциометр; термостат водяной на 37 °С; весы лабораторные общего назначения с наибольшим пределом взвешивания 200 г, поверочной ценой деления не более 0,5 мг; весы лабораторные общего назначения с наибольшим пределом взвешивания 500 г, поверочной ценой деления не более 50 мг; водяная баня.
Для люмифлавинового варианта дополнительно нужны две настольные лампы по 100 ватт (желательно с отражателями, направляющими свет на облучаемые колбы), настольный вентилятор.
Посуда
Колбы мерные вместимостью 100, 500, 1000 см ; колбы конические вместимостью 250 см
; колбы конические вместимостью 250 см ; колбы конические с притертой пробкой вместимостью 100 см
; колбы конические с притертой пробкой вместимостью 100 см ; бюретка на 100 см
; бюретка на 100 см ; цилиндры мерные вместимостью 25 см
; цилиндры мерные вместимостью 25 см ; пипетки, градуированные на 1, 2, 5 и 10 см
; пипетки, градуированные на 1, 2, 5 и 10 см ; воронки делительные вместимостью 250 см
; воронки делительные вместимостью 250 см , воронки фильтровальные диаметром 3, 5 и 8 см.
, воронки фильтровальные диаметром 3, 5 и 8 см.
Реактивы
1. Калий марганцевокислый х.ч.
2. Натрий гидроокись х.ч.
3. Натрий гидросернистокислый техн.
4. Натрий уксуснокислый 3-х водн. х.ч.
5. Натрия сульфат безводный х.ч.
6. Перекись водорода 30% х.ч.
7. Рибофлавин кристаллический (Гос. фармакопея СССР X изд., ст.585).
8. Кислота соляная х.ч.
9. Кислота уксусная ледяная х.ч.
10. Хлороформ для наркоза
11. Ферментные препараты амилоризин П10х или пектаваморин П10х.
Приготовление реактивов
1. Стандартные растворы рибофлавина. Растворяют 0,0200 г рибофлавина, предварительно высушенного в эксикаторе над серной кислотой или пятиокисью фосфора в течение 10 дней, в мерной колбе вместимостью 1000 см в 750 см
в 750 см дистиллированной воды. Для лучшего растворения добавляют 1 см
дистиллированной воды. Для лучшего растворения добавляют 1 см ледяной уксусной кислоты и слегка подогревают. После полного растворения рибофлавина раствор охлаждают до комнатной температуры, доводят объем водой до метки и тщательно перемешивают (раствор с массовой концентрацией рибофлавина 0,020 г/см
ледяной уксусной кислоты и слегка подогревают. После полного растворения рибофлавина раствор охлаждают до комнатной температуры, доводят объем водой до метки и тщательно перемешивают (раствор с массовой концентрацией рибофлавина 0,020 г/см ). Переносят в склянку темного стекла с притертой пробкой, добавляют 0,5 см
). Переносят в склянку темного стекла с притертой пробкой, добавляют 0,5 см толуола и сохраняют в темноте и на холоду не более 2-х месяцев. В день проведения анализа 5 см
толуола и сохраняют в темноте и на холоду не более 2-х месяцев. В день проведения анализа 5 см этого раствора, нагретого в темноте до комнатной температуры, помещают в мерную колбу вместимостью 100 см
этого раствора, нагретого в темноте до комнатной температуры, помещают в мерную колбу вместимостью 100 см и доводят объем до метки водой, перемешивают (рабочий раствор с массовой концентрацией рибофлавина 1 мкг/см
и доводят объем до метки водой, перемешивают (рабочий раствор с массовой концентрацией рибофлавина 1 мкг/см ).
).
2. Раствор соляной кислоты 0,1 н.
3. Насыщенный раствор натрия уксуснокислого.
4. Раствор калия марганцевокислого 3%.
5. Раствор перекиси водорода 3%, готовят свежий еженедельно.
6. Раствор гидроокиси натрия 7 н.
Ход определения
Интервал определения концентраций рибофлавина составляет при прямой флюорометрии 0,5-2 мкг/см при использовании люмифлавинового варианта - 0,03-0,20 мкг/см
при использовании люмифлавинового варианта - 0,03-0,20 мкг/см . Величину навески продукта и последующие разведения рассчитывают исходя из интервала указанных концентраций.
. Величину навески продукта и последующие разведения рассчитывают исходя из интервала указанных концентраций.
Навеску мелкоизмельченной средней пробы продукта помещают в коническую колбу вместимостью 250 см , приливают около 150 см
, приливают около 150 см 0,1 н раствора соляной кислоты и кипятят на водяной бане 40 минут. Затем охлаждают до комнатной температуры, доводят рН гидролизата до 4,5 (потенциометрически) с помощью насыщенного раствора уксуснокислого натрия, добавляют 100 мг амилоризина, 0,5 см
0,1 н раствора соляной кислоты и кипятят на водяной бане 40 минут. Затем охлаждают до комнатной температуры, доводят рН гидролизата до 4,5 (потенциометрически) с помощью насыщенного раствора уксуснокислого натрия, добавляют 100 мг амилоризина, 0,5 см толуола и помещают в термостат на 14-16 часов при 37 °С. На следующий день гидролизат охлаждают, доводят объем в мерном цилиндре до 250 см
толуола и помещают в термостат на 14-16 часов при 37 °С. На следующий день гидролизат охлаждают, доводят объем в мерном цилиндре до 250 см дистиллированной водой и фильтруют. Если исследуемый объект содержит много жира, то навеску перед гидролизом обрабатывают серным эфиром; возможно, также обработать эфиром уже готовый гидролизат.
дистиллированной водой и фильтруют. Если исследуемый объект содержит много жира, то навеску перед гидролизом обрабатывают серным эфиром; возможно, также обработать эфиром уже готовый гидролизат.
При анализе объектов, содержащих много пектиновых веществ (яблоки, крыжовник, смородина, тыква, кабачки и продукты их переработки) вместо амилоризина используют пектавамарин. При необходимости прервать анализ на 1-2 дня перед доведением объема до 250 см гидролизат кипятят 5 минут, охлаждают, доводят объем до 250 см
гидролизат кипятят 5 минут, охлаждают, доводят объем до 250 см и фильтруют. До проведения анализа фильтрат хранят в холодильнике в хорошо закрытой склянке.
и фильтруют. До проведения анализа фильтрат хранят в холодильнике в хорошо закрытой склянке.
Одновременно аналогичным образом ставят контрольную пробу на содержание рибофлавина в ферментных препаратах, используя те же количества ферментных препаратов и реактивов. При анализе многих видов продуктов стадия гидролиза совпадает с аналогичной стадией анализа на содержание тиамина, что позволяет проводить определения рибофлавина и тиамина в одной навеске.
Вариант прямой флюорометрии
Метод прямой флюорометрии неприменим при анализе объектов с очень низким содержанием рибофлавина (некоторые овощи, плоды, ягоды), готовых блюд и кулинарных изделий, а также при исследовании зерновых продуктов (круп, муки, зерна, хлеба и т.д.). В этих случаях предпочтительным является люмифлавиновый вариант.
В 4 флюорометрические пробирки наливают по 10 см фильтрата испытуемого образца. В 2 пробирки с фильтратом добавляют по 1 см
фильтрата испытуемого образца. В 2 пробирки с фильтратом добавляют по 1 см (очень точно) стандартного раствора, содержащего 1 мкг рибофлавина в 1 см
(очень точно) стандартного раствора, содержащего 1 мкг рибофлавина в 1 см . В 5-ю пробирку наливают 10 см
. В 5-ю пробирку наливают 10 см фильтрата контрольной пробы к 1 см
фильтрата контрольной пробы к 1 см воды. Во все пробирки добавляют по 1 см
воды. Во все пробирки добавляют по 1 см ледяной уксусной кислоты и перемешивают содержимое. Затем вносят по 0,5 см
ледяной уксусной кислоты и перемешивают содержимое. Затем вносят по 0,5 см 3% раствора KМnО
3% раствора KМnО ; смешивают и оставляют на 2 мин. Добавляют в каждую пробирку по 0,5 см
; смешивают и оставляют на 2 мин. Добавляют в каждую пробирку по 0,5 см 3% раствора Н
3% раствора Н О
О и энергично встряхивают для удаления избытка кислорода.
и энергично встряхивают для удаления избытка кислорода.
Измеряют флюоресценцию всех растворов на флюориметре со светофильтрами, имеющими максимум пропускания в области 350-480 нм (В - первичный) и 510-650 нм (В
- первичный) и 510-650 нм (В - вторичный). После этого добавляют в каждую пробирку небольшими порциями (по 15-25 мг) порошкообразный гидросернистокислый натрий, перемешивают и в течение 5-10 сек вновь измеряют флюоресценцию растворов. Повторяют эту операцию быстро еще раз, не допуская помутнения растворов за счет выделения свободной серы.
- вторичный). После этого добавляют в каждую пробирку небольшими порциями (по 15-25 мг) порошкообразный гидросернистокислый натрий, перемешивают и в течение 5-10 сек вновь измеряют флюоресценцию растворов. Повторяют эту операцию быстро еще раз, не допуская помутнения растворов за счет выделения свободной серы.
Для расчетов используют средние показания двух параллельных пробирок до и после добавления гидросернистокислого натрия. В последнем случае берут наименьшее значение флюоресценции, полученные при повтором восстановлении рибофлавина гидросернистокислым натрием. Содержание рибофлавина в исследуемом образце в мг на 100 г (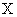 ) вычисляют по следующей формуле:
) вычисляют по следующей формуле:
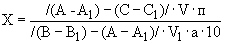 ,
,
где 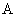 - интенсивность флюоресценции исследуемого образца без добавления стандартного раствора рибофлавина;
- интенсивность флюоресценции исследуемого образца без добавления стандартного раствора рибофлавина; 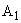 - то же после восстановления рибофлавина гидросернистокислым натрием;
- то же после восстановления рибофлавина гидросернистокислым натрием; 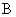 - интенсивность флюоресценции исследуемого образца с добавлением стандартного раствора рибофлавина;
- интенсивность флюоресценции исследуемого образца с добавлением стандартного раствора рибофлавина; 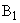 - то же после восстановления рибофлавина гидросернистокислым натрием;
- то же после восстановления рибофлавина гидросернистокислым натрием; 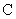 - интенсивность флюоресценции контрольного опыта;
- интенсивность флюоресценции контрольного опыта; 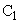 - то же после добавления гидросернистокислого натрия;
- то же после добавления гидросернистокислого натрия; 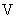 - объем гидролизата (см
- объем гидролизата (см );
); 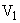 - количество гидролизата, взятого для окисления перманганатом калия (см
- количество гидролизата, взятого для окисления перманганатом калия (см );
); 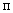 - количество добавленного рибофлавина (мкг);
- количество добавленного рибофлавина (мкг); 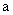 - навеска образца (г); 10 - коэффициент пересчета из мкг/г в мг/100 г продукта.
- навеска образца (г); 10 - коэффициент пересчета из мкг/г в мг/100 г продукта.
Люмифлавиновый вариант
К 100 мл фильтрата добавляют 2 см 30% раствора серной кислоты из пипетки 3% KМnО
30% раствора серной кислоты из пипетки 3% KМnО по каплям, постоянно перемешивая, до получения малинового окрашивания. Через одну минуту избыток перманганата калия удаляют добавлением по каплям 3% раствора перекиси водорода. Количество см
по каплям, постоянно перемешивая, до получения малинового окрашивания. Через одну минуту избыток перманганата калия удаляют добавлением по каплям 3% раствора перекиси водорода. Количество см израсходованных перманганата калия и перекиси водорода приплюсовывают к первоначально взятому на окисление объему фильтрата, чтобы определить конечный объем раствора.
израсходованных перманганата калия и перекиси водорода приплюсовывают к первоначально взятому на окисление объему фильтрата, чтобы определить конечный объем раствора.
Например: на окисление 100 см фильтрата израсходовано 1,8 см
фильтрата израсходовано 1,8 см 3% KМnО
3% KМnО и 0,2 см
и 0,2 см Н
Н О
О . Конечный объем будет 100 см
. Конечный объем будет 100 см +2 см
+2 см 30% серной кислоты+1,8 см
30% серной кислоты+1,8 см +0,2 см
+0,2 см =104 см
=104 см .
.
Полученный раствор переносят в делительную воронку, добавляют 30-50 см хлороформа и встряхивают 1 мин. После разделения слоев хлороформный слой отбрасывают, а водную фазу используют для дальнейшего определения. Одновременно аналогичным образом обрабатывают контрольную пробу, содержащую те же количества ферментных препаратов и реактивов, но без исследуемого образца.
хлороформа и встряхивают 1 мин. После разделения слоев хлороформный слой отбрасывают, а водную фазу используют для дальнейшего определения. Одновременно аналогичным образом обрабатывают контрольную пробу, содержащую те же количества ферментных препаратов и реактивов, но без исследуемого образца.
В 4 конические колбы с притертыми пробками наливают по 20 см экстракта исследуемого образца. В две из них добавляют по 2 см
экстракта исследуемого образца. В две из них добавляют по 2 см рабочего стандартного раствора рибофлавина, с массовой концентрацией 1 мкг в 1 см
рабочего стандартного раствора рибофлавина, с массовой концентрацией 1 мкг в 1 см . В 5-ю коническую колбу наливают 20 см
. В 5-ю коническую колбу наливают 20 см контрольной пробы. Во все колбы добавляют по 4 см
контрольной пробы. Во все колбы добавляют по 4 см 7 н раствора едкого натра, закрывают пробками, перемешивают и облучают их 40 мин светом двух настольных ламп по 100 ватт с расстояния 30 см. Температура окружающего воздуха не должна превышать 25°, для охлаждения используют настольный вентилятор. Немедленно после окончания облучения все растворы подкисляют 4 см
7 н раствора едкого натра, закрывают пробками, перемешивают и облучают их 40 мин светом двух настольных ламп по 100 ватт с расстояния 30 см. Температура окружающего воздуха не должна превышать 25°, для охлаждения используют настольный вентилятор. Немедленно после окончания облучения все растворы подкисляют 4 см ледяной уксусной кислоты, добавляют по 20 см
ледяной уксусной кислоты, добавляют по 20 см хлороформа, закрывают притертыми пробками и встряхивают колбы в течение 2-х минут, избегая образования эмульсии. Оставляют все колбы на 10-15 минут для расслоения водной и хлороформной фаз. С помощью пипетки с резиновой грушей и небольшой делительной воронки отбирают по 10-12 см
хлороформа, закрывают притертыми пробками и встряхивают колбы в течение 2-х минут, избегая образования эмульсии. Оставляют все колбы на 10-15 минут для расслоения водной и хлороформной фаз. С помощью пипетки с резиновой грушей и небольшой делительной воронки отбирают по 10-12 см хлороформного раствора, который фильтруют через бумажный фильтр с безводным сернокислым натрием в флюорометрические пробирки.
хлороформного раствора, который фильтруют через бумажный фильтр с безводным сернокислым натрием в флюорометрические пробирки.
Измеряют флюоресценцию полученных таким образом хлороформных растворов на флюориметре, используя те же светофильтры, которые указаны в варианте прямой флюорометрии.
Содержание рибофлавина (мг на 100 г продукта) вычисляют по формуле:
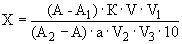 ,
,
где 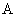 - среднее из показаний флюориметра для испытуемого образца без добавления стандартного раствора рибофлавина;
- среднее из показаний флюориметра для испытуемого образца без добавления стандартного раствора рибофлавина; 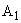 - то же для контрольного опыта на реактивы;
- то же для контрольного опыта на реактивы; 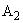 - среднее из показаний флюориметра для исследуемого образца с добавлением стандартного раствора рибофлавина ;
- среднее из показаний флюориметра для исследуемого образца с добавлением стандартного раствора рибофлавина ; 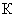 - количество добавленного рибофлавина (мкг);
- количество добавленного рибофлавина (мкг); 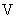 - общий объем гидролизата (см
- общий объем гидролизата (см );
); 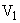 - объем гидролизата после окисления (см
- объем гидролизата после окисления (см );
); 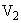 - объем гидролизата, взятый на окисление (см
- объем гидролизата, взятый на окисление (см );
); 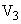 - объем гидролизата, взятый на облучение (см
- объем гидролизата, взятый на облучение (см );
); 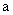 - навеска продукта (г); 10 - коэффициент пересчета из мкг/г в мг/100 г продукта.
- навеска продукта (г); 10 - коэффициент пересчета из мкг/г в мг/100 г продукта.
Вычисления проводят до второго знака после запятой. Расхождение между двумя параллельными определениями не должно превышать 10% от среднего арифметического значения.