Методические рекомендации. Методы бактериологического исследования условно-патогенных микроорганизмов в клинической микробиологии
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
МЕТОДЫ БАКТЕРИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ УСЛОВНО-ПАТОГЕННЫХ МИКРООРГАНИЗМОВ В КЛИНИЧЕСКОЙ МИКРОБИОЛОГИИ
УТВЕРЖДЕНЫ Министерством здравоохранения РСФСР от 19 декабря 1991 г.
Методические рекомендации составил А.Н.Калюк.
Бактериологические исследования на условно-патогенные микроорганизмы
Комплексное лабораторное изучение микрофлоры включает бактериоскопическое и бактериологическое исследования материала, проводимые в динамике при поступлении на стационарное лечение, в процессе лечения, а также по показаниям у больных, лечащихся амбулаторно. Посевы диагностического материала целесообразно производить на плотные питательные среды, что исключает подавление роста одного микроорганизма другим и позволяет дать количественную оценку числа выросших колоний. Интенсивность роста микроорганизмов может выражаться в крестах и соответствовать содержанию определенного количества микробных клеток в 1 мл диагностического материала:
++++ обильный рост сливающихся колоний (10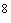 м/кл)
м/кл)
+++ массивный рост изолированных колоний (10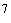 м/кл)
м/кл)
++ умеренный рост множества сосчитываемых колоний (не менее 50) (10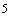 -10
-10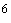 м/кл)
м/кл)
+ скудный рост единичных колоний (30-50) (10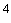 м/кл).
м/кл).
При дозированном посеве определяют абсолютное содержание микроорганизмов в 1 мл или 1 г исследуемого материала. Этиологически значимым содержанием бактерий в 1 мл (1 г) материала признается 10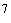 и выше. Количественное преобладание определенного вида микроорганизма является одним из показателей его участия в гнойно-воспалительном процессе. Окончательная интерпретация результатов бактериологического исследования производится после изучения анамнестических данных, клинической симптоматики, результатов антибактериальной терапии. При направлении материала на посев необходимо соблюдать определенные правила. Материал должен быть исследован до начала антибактериальной терапии или через такой период после введения антибактериальных препаратов, который необходим для их элиминации из организма больного (2-3 дня при анализах мокроты, 4-7 дней - мочи). Применение антибиотиков в 3-4 раза снижает частоту выделения микроорганизмов. Посевы диагностического материала проводятся в динамике (3-5 раз), что уточняет этиологию заболевания, дает возможность проследить длительность персистенции возбудителя, контролировать эффективность проводимой терапии. Интервал между сбором и посевом материала не должен превышать 1-2 ч.
и выше. Количественное преобладание определенного вида микроорганизма является одним из показателей его участия в гнойно-воспалительном процессе. Окончательная интерпретация результатов бактериологического исследования производится после изучения анамнестических данных, клинической симптоматики, результатов антибактериальной терапии. При направлении материала на посев необходимо соблюдать определенные правила. Материал должен быть исследован до начала антибактериальной терапии или через такой период после введения антибактериальных препаратов, который необходим для их элиминации из организма больного (2-3 дня при анализах мокроты, 4-7 дней - мочи). Применение антибиотиков в 3-4 раза снижает частоту выделения микроорганизмов. Посевы диагностического материала проводятся в динамике (3-5 раз), что уточняет этиологию заболевания, дает возможность проследить длительность персистенции возбудителя, контролировать эффективность проводимой терапии. Интервал между сбором и посевом материала не должен превышать 1-2 ч.
Исследование микрофлоры верхних дыхательных путей (глотка, нос, ротовая полость). Материалом для исследования служат: слизь, гнойное отделяемое, корочки, пленка, кусочки инфильтратов при биопсии. Материал для микробиологического исследования из ротовой полости забирают натощак стерильным ватным тампоном со слизистой оболочки у выхода протоков слюнных желез, поверхности языка, из язвочек (соскоб ложечкой), с наиболее пораженных мест. При наличии пленки последнюю снимают пинцетом. Материал из носовой полости забирают сухим стерильным ватным тампоном. Материал засевают на чашки Петри с кровяным, желточно-солевым агарами, среду Сабуро. При посеве тампоном материал втирают в среду со всей поверхности тампона на небольшом участке 1-2 см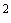 , а затем штрихами по всей поверхности. Одновременно с посевом приготавливают мазки и окрашивают по Граму.
, а затем штрихами по всей поверхности. Одновременно с посевом приготавливают мазки и окрашивают по Граму.
Исследование микрофлоры нижних дыхательных путей. Основным материалом для исследования является мокрота, которая собирается в день исследования, утром, после чистки зубов и полоскания полости рта свежекипяченой водой. При обильном выделении мокроты первые порции следует откашлять в плевку, а последующие собираются в стерильную посуду и доставляются в лабораторию. Для изучения микрофлоры мокроты применяют как посев неразведенной мокроты (качественный метод), так и метод разведения, который получил название количественного. При качественном методе для посева используются гнойные комочки мокроты, отмытые в физиологическом растворе от микрофлоры ротовой полости. При количественных методах гомогенизируется 1 мл мокроты. Затем производятся разведения, позволяющие уменьшить в ней количество микроорганизмов ротовой полости. При обоих методах одновременно с посевом приготавливается мазок, который окрашивается по Граму. Исследованию подлежат гнойная и слизисто-гнойная мокрота, в которой присутствуют лейкоциты и клетки альвеолярного эпителия, клетки, вкрапленные в муцин, присутствие которых характерно для экскрета нижних отделов дыхательных путей. Обращают внимание на преобладающую в мазке нативной мокроты микрофлору, особенно капсульные диплококки (пневмококки), мелкие грамотрицательные палочки (палочка Пфейффера) и др.
Качественный метод. В лаборатории мокроту выливают в чашку Петри, выбирают 2-3 гнойных комочка, которые однократно отмывают в физиологическом растворе, после чего засевают на кровяной и желточно-солевой агары, среды Эндо и Сабуро. Посев производят стерильным стеклянным шпателем, равномерно растирая материал на поверхности питательной среды. На чашку с кровяным агаром сразу же после посева накладывают диски с антибиотиками (стрептомицином, пенициллином, тетрациклином, эритромицином и левомицетином), что позволяет получить экспресс-информацию о лекарственной чувствительности преобладающей в посеве микрофлоры. На второй день учитывают количество выросших колоний (этиологически значимым считается рост более 50 колоний), однородность популяции и лекарственную чувствительность при росте их в монокультуре.
Количественный метод. Из доставленной в лабораторию мокроты берут 1 мл, добавляют 9 мл мясопептонного бульона и гомогенизируют в банке с бусами в течение 20 мин. Из полученной эмульсии готовят десятикратные последовательные разведения. Посев осуществляют в обратном порядке с меньшего разведения. Засевается по 0,1 мл из разведенной мокроты 10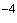 и 10
и 10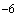 на чашку с кровяным агаром. Посев на желточно-солевой агар, среды Эндо и Сабуро делают из исходного разведения 1:10. Посевы инкубируют в течение суток при 37°С. На вторые сутки чашки просматривают и учитывают численность каждого из видов микроорганизмов в миллионах. Диагностически значимым признается содержание бактерий 10
на чашку с кровяным агаром. Посев на желточно-солевой агар, среды Эндо и Сабуро делают из исходного разведения 1:10. Посевы инкубируют в течение суток при 37°С. На вторые сутки чашки просматривают и учитывают численность каждого из видов микроорганизмов в миллионах. Диагностически значимым признается содержание бактерий 10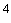 м/кл и выше в 1 мл мокроты.
м/кл и выше в 1 мл мокроты.
Посев промывных вод бронхов, лаважной жидкости. Из исследуемого материала отбирают комочки слизи, которые без предварительного отмывания в физиологическом растворе засевают на плотные питательные среды (см. посев мокроты) и в пробирку с сахарным бульоном. При отсутствии комочков слизи производят посев материала, набранного в пастеровскую пипетку. Инкубация в течение суток при 37°С.
Исследование микрофлоры глаз. Пробы на исследование отбирает врач стерильным ватным тампоном или стеклянной палочкой. Материал забирается с пораженных мест и засевается в 0,5% сахарный бульон. В случае отсутствия роста через 48 часов выдается отрицательный ответ.
Исследование мазков из уха. Материал забирают стерильным ватным тампоном из слухового канала и производят посев на кровяной и желточно-солевой агары, среду Сабуро, втирая материал на участке среды, после чего растирают по всей чашке.
Исследование мочи. Исследованию подлежит средняя порция утренней мочи, полученная при нормальном мочеиспускании или взятая катетером. Показателем бактериурии, имеющим клиническое значение, считается наличие 100000 и более микробов в 1 мл мочи.
Первый день исследования. Производят посев одной стандартной (3 мм) бактериологической петли мочи (тщательно перемешанной) по секторам А, I, II и III в чашку Петри с 5% кровяным или простым агаром. При этом в участке среды сектора А делают посев, равномерно втирая материал по всей поверхности, затем не беря нового материала, этой же петлей делают посев штрихами на питательную среду в секторе I (3-4 штриха), из сектора I во II, из II сектора - в III.
Таблица 1
Число колоний бактерий в различных секторах чашки Петри в зависимости от степени бактериурии (по В.С.Рабиновскому и В.В.Родоман)
|
Количество бактерий в 1 мл мочи |
Число колоний в различных секторах чашки Петри |
|||
|
А |
I |
II |
III |
|
|
Менее 1 тыс. |
1-6 |
роста нет |
роста нет |
" |
|
1 тыс. |
20-30 |
" |
" |
" |
|
5 тыс. |
30-60 |
" |
" |
" |
|
10 тыс. |
70-80 |
" |
" |
" |
|
50 тыс. |
100-150 |
" |
" |
" |
|
100 тыс. |
очень |
5-10 |
" |
" |
|
500 тыс. |
большое |
20-30 |
" |
" |
|
1 млн. |
" |
40-60 |
" |
" |
|
5 млн. |
" |
100-140 |
10-20 |
" |
|
10 млн. |
" |
очень большое |
30-40 |
" |
|
50 млн. |
" |
" |
60-80 |
единич. |
|
100 млн. |
" |
" |
80-140 |
от единич. до 25 |
Второй день исследования. Определяют степень бактериурии по табл.1 в зависимости от того, в каком секторе обнаружен рост колоний микроорганизма. При наличии менее 100 тыс. микробов в 1 мл мочи рост колоний наблюдается только в секторе А чашки Петри. Появление роста колоний в I секторе указывает на более высокую степень бактериурии. Подсчет колоний в секторе с наименьшим ростом не представляет труда. Метод секторных посевов в большинстве случаев позволяет уже на второй день исследования выделить возбудителя заболевания в чистой культуре.
Исследование микрофлоры ран, пунктатов, экссудатов, резецированных тканей. Экссудаты и пунктаты засевают пастеровской пипеткой в пробирки с кровяным и простым мясопептонным агаром, сахарным бульоном. Тампон с диагностическим материалом засевают на чашки Петри с 5% кровяным и 10% желточно-солевым агарами. Материал втирается по краю среды, а затем рассеивается по чашке при помощи этого же тампона или бактериологической петли.
Исследование микрофлоры женских половых органов. Выделения собирают с помощью стерильного ватного тампона и засевают на чашки Петри с 5% кровяным агаром, желточно-солевым агаром и в пробирку с сахарным бульоном, а также на среду Эндо.
Исследование желчи. Желчь собирают при зондировании или во время операции в стерильные пробирки и доставляют в лабораторию не позднее 2 ч. от момента забора. 0,1 мл желчи высевают на чашку с кровяным агаром и на среду Эндо. Посевы и оставшийся исходный материал помещают в термостат при 37°С. Через 24 часа учитывают результаты первичных посевов с подсчетом количества колоний каждого вида на плотных питательных средах.
Исследование крови. Кровь сеют у постели больного после тщательной обработки кожи (спирт, эфир). Из локтевой вены берут 10 мл крови, которую выливают в две колбы: первую со 150-200 мл сахарного бульона и вторую с тиогликолевой средой (по 5 мл). Посевы выдерживают в термостате в течение 10 дней. На 2, 3, 5 и 10-й дни производят контрольные высевы на чашки Петри с 5% кровяным агаром. Посев 5 мл крови можно произвести во флакон с питательной средой в двух фазах: плотной и жидкой (скос 5% кровяного агара с 1% глюкозы и 50 мл 0,5% сахарного бульона). Такая методика исключает необходимость многократных пересевов, устраняет возможность загрязнения посева микрофлорой окружающей среды, позволяет учесть количество выросших колоний (т.е. оценить напряженность бактериемии). Посев помещают в термостат при 37°С на 10 суток. Ежедневно содержимое флаконов взбалтывают и наклоном флакона смачивают поверхность скоса плотной питательной среды. При появлении роста колоний на скосе кровяного агара с них приготавливают мазки и далее идентифицируют по общепринятым в бактериологии правилам. При отсутствии роста микроорганизмов на 10-е сутки дается окончательный ответ - посев крови стерилен.
Исследование на дисбактериоз кишечника. На предварительно подготовленные и взвешенные (подпергамент или вощанку) стерильные бумажки размером 3x2 берут произвольное количество фекалий и взвешивают на торзионных весах. Бумажку вместе с материалом помещают в стерильную пробирку. Вес навески фекалий, за вычетом веса бумажки, умножают на 9. Полученная после умножения сумма равна количеству физиологического раствора, которое необходимо добавить в пробирку. Разведение 1:10 (I).
Например: вес бумажки 20 мг
вес фекалий с бумажкой 420 мг
420-20=400 мг; 400 мг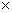 9=3600 (3,5 мл).
9=3600 (3,5 мл).
После эмульгирования стеклянной палочкой или стерильной пипеткой взвеси дают отстояться при комнатной температуре 10-15 мин и 0,1 мл переносят в следующую пробирку с 9,9 мл физиологического раствора (разведение 10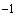 ). Затем производят разведение фекалий до титра 10
). Затем производят разведение фекалий до титра 10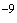 . Из основного разведения (10
. Из основного разведения (10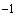 ) производят посев на плотные питательные среды для выделения патогенных микробов семейства кишечных (среду Плоскирева, Левина). Одновременно делают массивный (0,5-1,0) посев на жидкие среды обогащения (Мюллера, селенитовую, магниевую). Из пробирки, в которой фекалии разведены до 10
) производят посев на плотные питательные среды для выделения патогенных микробов семейства кишечных (среду Плоскирева, Левина). Одновременно делают массивный (0,5-1,0) посев на жидкие среды обогащения (Мюллера, селенитовую, магниевую). Из пробирки, в которой фекалии разведены до 10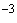 , вносят по 0,1 мл на поверхность среды Сабуро и ЖСА. Из разведения 10
, вносят по 0,1 мл на поверхность среды Сабуро и ЖСА. Из разведения 10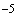 производят посевы на чашки с 0,5% кровяным агаром и среду Эндо по 0,1 мл. Для получения роста изолированных колоний применяют стеклянные бусы или шпатели. Стеклянные круглые бусы 12-14 штук (заранее простерилизованные) опускают в чашку с посевным материалом. При легком покачивании чашки с бусами в течение 1 мин материал равномерно распределяется по питательной среде. Посев бусами начинают со среды, на которой посеяно наибольшее разведение (10
производят посевы на чашки с 0,5% кровяным агаром и среду Эндо по 0,1 мл. Для получения роста изолированных колоний применяют стеклянные бусы или шпатели. Стеклянные круглые бусы 12-14 штук (заранее простерилизованные) опускают в чашку с посевным материалом. При легком покачивании чашки с бусами в течение 1 мин материал равномерно распределяется по питательной среде. Посев бусами начинают со среды, на которой посеяно наибольшее разведение (10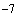 ), перенося бусы на меньшее разведение. Для выделения анаэробных бифидобактерий производят высев из разведений 10
), перенося бусы на меньшее разведение. Для выделения анаэробных бифидобактерий производят высев из разведений 10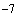 , 10
, 10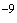 и 10
и 10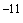 в 2 пробирки (по 0,1 и 1 мл) регенерированной в течение 1 ч среды Блаурокка. После посева пробирки энергично вращают между ладонями для равномерного распределения взвеси. Среды для выращивания аэробов помещают в термостат при 37°С (Сабуро - при 20°) на 18-24 часа. Рост анаэробов на среде Блаурокка учитывают через 48-72 ч. На следующий день после посева определяют количество кишечной палочки и других микробов в 1 г фекалий по числу колоний, выросших на соответствующей питательной среде с пересчетом на количество посеянного материала и степени его разведения. Так, если на среде Эндо выросло 30 лактозонегативных колоний при посеве 0,1 мл фекалий из разведения 10
в 2 пробирки (по 0,1 и 1 мл) регенерированной в течение 1 ч среды Блаурокка. После посева пробирки энергично вращают между ладонями для равномерного распределения взвеси. Среды для выращивания аэробов помещают в термостат при 37°С (Сабуро - при 20°) на 18-24 часа. Рост анаэробов на среде Блаурокка учитывают через 48-72 ч. На следующий день после посева определяют количество кишечной палочки и других микробов в 1 г фекалий по числу колоний, выросших на соответствующей питательной среде с пересчетом на количество посеянного материала и степени его разведения. Так, если на среде Эндо выросло 30 лактозонегативных колоний при посеве 0,1 мл фекалий из разведения 10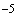 (1:100000), при расчете следует 30 умножить на 10 и на 100000, т.е. в 1 г будет 30000000 лактозонегативных энтеробактерий. Учитывают число лактозонегативных и гемолитических колоний кишечной палочки, наличие стафилококка, протея и других микроорганизмов. Определяются ферментативные свойства и лекарственная чувствительность микроорганизмов. Из пробирок со средой Блаурокка приготавливаются мазки. Под микроскопом бифидобактерий имеют вид характерных грамположительных палочек, утолщенных или разветвленных на концах, расположенных в виде римской цифры V, часто в виде скоплений. В ответе бактериолога указываются процент или абсолютное количество каждой группы микроорганизмов.
(1:100000), при расчете следует 30 умножить на 10 и на 100000, т.е. в 1 г будет 30000000 лактозонегативных энтеробактерий. Учитывают число лактозонегативных и гемолитических колоний кишечной палочки, наличие стафилококка, протея и других микроорганизмов. Определяются ферментативные свойства и лекарственная чувствительность микроорганизмов. Из пробирок со средой Блаурокка приготавливаются мазки. Под микроскопом бифидобактерий имеют вид характерных грамположительных палочек, утолщенных или разветвленных на концах, расположенных в виде римской цифры V, часто в виде скоплений. В ответе бактериолога указываются процент или абсолютное количество каждой группы микроорганизмов.
Идентификация микроорганизмов. Методы идентификации микроорганизмов основаны на изучении морфологических, культуральных и биохимических, антигенных и др. свойств культур.
Морфологические свойства изучаются путем бактериоскопии диагностического материала и мазков из колоний, выросших на плотных и жидких питательных средах культур. Мазки на предметных стеклах фиксируют на пламени горелки или в жидких фиксаторах (96°, спирт, смесь Никифорова) окрашивают по Граму. При просмотре мазков из мокроты оценивают всю имеющуюся микрофлору: наличие скоплений грамположительных кокков (стафилококки, микрококки), цепочек грамположительных кокков (стрептококки), мелких ланцетовидных диплококков, окруженных зоной неокрасившейся капсулы (пневмококк), грамотрицательных кокков (нейссерии); грамотрицательных палочек (кишечная, синегнойная, протей); грамотрицательных палочек с закругленными концами, окруженных капсулой в виде светлого ореола (клебсиелла), мелких грамотрицательных палочек в виде скопления (гемофильные бактерии) и др. Бактериоскопическое исследование является ориентировочным. Дальнейшее исследование включает посев материала на питательные среды, выделение чистых культур, их идентификацию и определение лекарственной чувствительности. Культуральные свойства изучают при просмотре выросших культур на плотных и жидких питательных средах. На плотных средах учитывают размер колоний, цвет, прозрачность, форму, наличие пигмента, гемолиз вокруг колонии и его характер и т.д. На жидких средах отмечают их прозрачность, наличие осадка (придонный рост) или пленки на поверхности среды. Исследование биохимических свойств основывается на определении ферментативной сахаролитической активности, способности утилизировать питательные вещества в аэробных и анаэробных условиях культивирования. Антигенные свойства культур изучаются при взаимодействии бактерий и их антигенов с соответствующими антисыворотками (реакции агглютинации, иммунофлюоресценции и др.). После изучения морфологических и культуральных свойств осуществляют постановку дифференциальных тестов с чистыми культурами микроорганизмов.
Грамположительные кокки. Грамположительные кокки относятся к семейству Micrococcaceae, включающему род Micrococcus и Staphylococcus и семейства Streptococcaceae.
Семейство Micrococcaceae. Для медицинской микробиологии необходимо дифференцировать стафилококки от микрококков. Изучают морфологические свойства, гемолиз, способность расти на среде с солью, пигментообразование, ферментацию глюкозы до кислоты в анаэробных условиях, ферментацию глицерина. Микрококки имеют в 2-3 раза больший размер клеток (0,5-3,5 мкм), не ферментируют глюкозу в анаэробных условиях и глицерин, имеют пигмент от желтого до розового. Дифференциация различных видов стафилококка осуществляется по комплексу тестов: плазмокоагулирующей способности, лецитиназной активности, ферментации маннита в анаэробных условиях, пигментообразованию, чувствительности к новобиоцину (тест - положительный у St. aureus и St. epidermidis и отрицательный у St. saprophyticus). Для выделения стафилококка исследуемый материал засевают на дифференциально-диагностическую среду: желточно-солевой агар. При окраске по Граму стафилококк окрашивается грамположительно и располагается одиночно, попарно или образует скопления в виде неправильных кучек. Стафилококк устойчив к повышенным концентрациям в среде хлористого натрия (7-10%), что используется для его выделения из патологического материала. При росте на мясопептонном бульоне вызывает его равномерное помутнение и дает хлопьевидный осадок. На плотных питательных средах стафилококк растет в виде круглых блестящих колоний с ровными краями (0,5-1,5 мм в диаметре). На второй день исследования оценивают количественный рост выросших колоний, учитывают лецитиназную активность, выделяют чистую культуру микроба (пересев на пробирки с молочным или простым скошенным агаром). На третий день - ставят тесты для дифференциации и на лекарственную чувствительность.
При определении коагулазной активности пользуются лиофилизированной плазмой крови кролика, разведенной стерильным физиологическим раствором 1:5 и разлитой в стерильные пробирки по 0,5 мл в каждую. В пробирку засевают 1 петлю суточной агаровой культуры исследуемого штамма и помещают в термостат при 37°С. Учет результатов производят через 30 мин, 1 час, 2 часа и 24 часа. Положительными считаются все степени свертывания плазмы от небольшого сгустка, остающегося неподвижным при перевертывании пробирки.
Лецитиназная активность определяется на желточно-солевом агаре. Учет реакции производят через 24-48 часов макроскопически по наличию мутной зоны и радужного венчика вокруг колоний стафилококка, что свидетельствует о наличии у них фермента лецитиназы.
При изучении ферментации маннита посев суточной агаровой культуры испытуемого штамма производят уголком в столбик 1% агара с маннитом и вазелиновым маслом. При ферментации маннита столбик агар синеет. Положительной считается реакция при ферментации 2/3 столбика агара.
Для определения пигментообразования культуры стафилококка засевают на 10% молочный агар. Учет через 18-20 часов.
Определение гемолитической способности культуры стафилококка осуществляется на 5% кровяном агаре (донорская кровь без добавления антисептиков) по наличию просветления вокруг выросших колоний, которые четко выявляются в проходящем свете. Положительный гемолитический тест на агаре с кровью человека, как правило, обусловлен гемотоксинами, тогда как основную роль в патогенезе стафилококковых инфекций играет альфа-токсин, который можно выявить на агаре с кровью кролика.
Семейство Streptococcaceae. Стрептококки представляют собой большую и довольно гетерогенную группу микроорганизмов. Наиболее изученными являются аэробные представители: Streptococcus pyogenes, S. faecalis, S. pneumoniae. Микроб имеет сферическую форму, грамположителен, в мазках с плотных питательных сред располагается в виде коротких цепочек из 2-3 кокков, на жидких питательных средах дает более длинные цепочки. При выращивании стрептококков следует учитывать их повышенную потребность в питательных веществах. Поэтому для культивирования стрептококка применяют питательные среды, содержащие глюкозу (1%), кровь (5-10%), сыворотку (10-20%).
На кровяном агаре стрептококк растет в виде мелких, прозрачных с гладким краем колоний. Отношение к кровяному агару является одним из важнейших свойств стрептококков, в значительной мере определяющих их патогенность. Качество гемолиза определяется через 24 ч по зоне просветления вокруг колоний. В-гемолитические стрептококки (Str. pyogenes) через 24 часа после посева дают вокруг колоний зону полного просветления за счет полного лизиса эритроцитов. При последующем хранении чашечек при температуре +4°С в течение 24 часов зона гемолиза не увеличивается. Альфа-зеленящие стрептококки (Str. viridaus) имеют ограниченную зону лизиса, иногда с зеленым пигментом (явление гемометаморфоза - стрептококки способствуют перекрашиванию пигмента крови в зеленый цвет), гамма-негемолитические стрептококки не вызывают изменений кровяного агара. На сахарном бульоне стрептококки растут придонно и пристеночно, оставляя бульон прозрачным. Образуют хлопьевидный, иногда гомогенный осадок. По Ленсфилд, дифференциация стрептококка осуществляется с помощью реакции преципитации по наличию полисахаридного антигена. Стрептококки группы А дают гемолиз на кровяном агаре, не редуцируют метиленовую синь в молоке, чувствительны к пенициллину. Энтерококк является обитателем кишечника человека, однако может вызывать энтероколиты, циститы и пр. В отличие от стрептококков группы А он редуцирует метиленовую синь в молоке, не чувствителен к пенициллину, растет на средах с повышенным содержанием поваренной соли (6,5%, в 40% желчном бульоне и бульоне рН 9,6). В отношении углеводов стрептококки не активны. Стрептококк нередко погибает во время пересевов. Поэтому целесообразно использовать все данные, полученные при посеве на первичную чашку Петри с 5% кровяным агаром; характер гемолиза, лекарственную чувствительность. При необходимости чистую культуру стрептококка можно выделить путем пересева типичной колонии секторами на чашку Петри с кровяным агаром. Пневмококк, как и другие стрептококки, может быть причиной гнойных процессов в любом органе (гнойный отит, гайморит, ангина и т.д.); он является специфическим возбудителем крупозной пневмонии. Из диагностического материала (кроме крови) обязательно приготавливаются мазки, окрашенные по Граму. Обнаружение в них грамположительных капсульных диплококков свидетельствует о наличии пневмококка. Для его выделения материал засевают на чашки Петри с 5% кровяным агаром или в сахарный бульон. Для приготовления кровяного агара лучше использовать фибринированную кровь кролика (2,5%), барана или лошади. При работе с кровью человека в среду добавляют дрожжевой экстракт. Питательные среды хранятся не более 2 недель. Посевы просматривают после инкубации при 37°С в течение 16-18 часов. На кровяном агаре колонии пневмококков нежные, мелкие, зеленовато-серые, окружены ореолом, напоминающим гемолиз. Характерно вдавление в центре колонии. На сахарном бульоне пневмококк дает тонкое равномерное помутнение, иногда небольшой осадок. Ферментация инулина имеет дифференциально-диагностическое значение для определения этого вида стрептококка. Жизнеспособность пневмококков непродолжительна, они быстро погибают при воздействии обычных дезинфицирующих средств, особенно чувствительны к желчи и ее солям. Стрептококк, колонии которого сходны с пневмококком, не лизируется желчью. Для идентификации микроба в пробирку с 10% желчным бульоном засевают 2-3 мл суточной культуры исследуемого штамма. Пробирку помещают на 18-24 ч в термостат при 37°С. Просветление содержимого пробирки (лизис микроба) позволяет отнести исследуемую культуру к пневмококкам.
Грамотрицательные кокки. Грамотрицательные кокки и коккабациллы представлены родами: Neisseria, Branchamella, Moraxella.
К роду Neisseria относятся патогенные виды - N. meningitidis и N. gonorrheae и несколько сапрофитных видов: N. Alavesecns, N. subflava, N. mucosa, N. sicca и др.
Менингококк является возбудителем эпидемического цереброспинального менингита, но может также вызывать сепсис, ринофарингиты и пр. Отмечено носительство микроба в носоглотке здоровых людей. Для выделения микроорганизма спинномозговая жидкость центрифугируется и осадок засевается на 5% кровяной агар, 20% сывороточный агар, сахарный бульон. Отрицательный результат исследования не говорит против инфекции, так как применение антибиотиков и сульфаниламидных препаратов значительно снизило высеваемость менингококка. В связи с этим большое значение имеет приготовление и микроскопия мазка из осадка, полученного при центрифугировании спинномозговой жидкости. Менингококк - это грамотрицательный диплококк, имеющий форму кофейного зерна, клетки обращены друг к другу вогнутыми сторонами, полиморфны. Наличие в мазках грамотрицательных диплококков бобовидной формы, расположенных внутриклеточно, свидетельствует о присутствии менингококка. На плотных питательных средах менингококк растет в виде мелких, слегка выпуклых, голубоватых колоний, с ровными краями. Через 2-3 суток выращивания при 37°С колонии увеличиваются в размерах, и их край становится неровным. При обнаружении грамотрицательных диплококков в мокроте, мазках из зева и пр. необходимо провести дифференциацию менингококка от неотличимых от него бактериоскопически грамотрицательных микрококков. Для этого выделенные чистые культуры микроорганизма изучают в отношении биохимических свойств (табл.2).
Таблица 2
Ферментация углеводов представителями рода Neisseria и Branchamella
|
Микроорганизм |
Капсула |
Глюкоза |
Сахароза |
Мальтоза |
Пигмент |
|
Neisseria meningitidis |
+/- |
К |
- |
К |
- |
|
Neisseria flavescens |
- |
- |
- |
- |
+ |
|
Neisseria subflava |
+ |
К |
- |
К |
+ |
|
Neisseria mucosa |
+ |
К |
К |
К |
- |
|
Neisseria sicca |
+/- |
К |
К |
К |
+/- |
|
B. catarrhalis |
+ |
- |
- |
- |
- |
Примечание: К - образование кислоты.
Микроорганизмы родов Branchamella и Moraxella являются возбудителями конъюнктивитов человека. В. catarrhalis в мазках располагается в виде липлококков, образует капсулу, углеводы не ферментирует. М. lacunata имеет вариабельную морфологию - от мелких кокков до толстых коротких палочек, расположенных парами или короткими цепочками, капсулы не образуют, углеводы не ферментируют. На кровяном агаре растут в виде мелких колоний, образующих вокруг большие темные зоны.
Гемофильные палочки. Гемофильные палочки относятся к роду Haemophilus, включающих патогенные и непатогенные для человека виды. Они выделяются при исследовании диагностического материала верхних дыхательных путей: Н. influenzae, Н. parainfluenzae, Н. haemolyticus (сапрофит) и пр.
Бактерии инфлюэнцы - очень мелкие, чрезвычайно полиморфны от кокковидных до длинных нитевидных форм, неподвижны, грамотрицательны, хорошо окрашиваются слабыми растворами фуксина. В мазках палочки чаще располагаются в виде скоплений. Микробы неустойчивы к внешним воздействиям и быстро погибают вне живого организма. Для культивирования требуют присутствия в средах факторов роста (X и Y). Х-фактор связан с гематином и находится в крови, не разрушается при нагревании до 120°С. Y-фактор содержится в животных и растительных тканях, вырабатывается некоторыми бактериями, термолабилен. Оптимальными средами для выращивания являются 10% кровяной агар или агар Левинталя. На кровяном агаре вырастают мелкие, плоские, с выпуклым центром прозрачные колонии, иногда сливающиеся между собой, гемолиза не дают. При культивировании на среде Левинталя колонии больших размеров имеют куполообразную форму. В жидких кровяных средах микроб дает гомогенный рост с небольшим порошковидным осадком на дне. Ферментативные свойства не постоянны. Палочки инфлюэнцы сбраживают глюкозу, декстрозу, левулезу, галактозу, мальтозу и сахарозу с образованием кислоты. Они никогда не сбраживают лактозу и маннит, патогенны для лабораторных животных.
Грамотрицательные палочки. К семейству Enterobacteriaceae относятся грамнегативные палочки, хорошо растущие на обычных питательных средах, подвижные или неподвижные, расщепляющие глюкозу путем ферментации, не имеющие цитохромоксидазы, редуцирующие нитраты в нитриты. После установления принадлежности штамма к Enterobacteriaceae определяют внутри семейства другие таксономические свойства. При этом основное значение имеет изучение ферментативной характеристики культур. Биохимические признаки кишечных бактерий в пределах рода непостоянны. Поэтому при идентификации используют ряд биохимических тестов, а также изучают аминокислотный метаболизм. Дифференциация проводится до определения рода микроорганизма. Принадлежность микроба к одному из родов семейства Enterobacteriaceae устанавливается по ряду биохимических тестов (табл.3). Изучают подвижность, ферментацию глюкозы, лактозы, маннита, разложение мочевины, усвоение цитрата, разжижение желатины, образование индола и сероводорода, утилизацию малоната, дезаминирование фенилаланина, декарбоксилирование лизина. Схема дифференциации грамотрицательных бактерий представлена в табл.4.
Посев материала производится на среды: Эндо, простой питательный агар, 5% кровяной агар. На второй день выделяют чистые культуры микроорганизмов и приготавливают мазки. На третий день изучают биохимические свойства и лекарственную чувствительность. Производят посев на среду Олькеницкого (3-сахарный агар с мочевиной) для изучения ферментации глюкозы, лактозы, разложения мочевины и образования сероводорода; в пробирку со средой Симмонса, полужидким агаром, в среды с фенилаланином, малонатом натрия, лизином, в бульон Хоттингера для определения лекарственной чувствительности опускают полоску рентгеновской пленки. При необходимости более полной идентификации набор тестов может быть увеличен. В настоящее время для идентификации грамотрицательных бактерий выпускаются системы индикаторные бумажные (СИБ). Системы имеют набор для межродовой дифференциации по 9 основным биохимическим свойствам: утилизация цитрата и малоната натрия, ферментация лактозы; наличие бета-галактозидазы, фенилаланиндезаминазы, уреазы, декарбоксилазы лизина; образование индола и сероводорода. Полная идентификация до рода включает 25 биохимических тестов.
Escherichia. Морфологически Е. coli прямая, толстая палочка с закругленными концами, грамотрицательна, подвижна. В отношении питательных сред непритязательна. На поверхности плотных питательных сред кишечная палочка растет в виде круглых, серовато-голубоватых (малиново-красных на среде Эндо) колоний с металлическим блеском, некоторые штаммы дают гемолиз на кровяном агаре. В бульоне - равномерное помутнение, к концу первых суток образуют индол. Первичное распознавание кишечной палочки основывается на ее способности разлагать с образованием кислоты и газа глюкозу, лактозу, маннит. Способность кишечной палочки сбраживать лактозу с образованием кислоты и газа отличает ее от других представителей кишечной группы. Чистую культуру микроба выделяют на скошенный мясопептонный агар. Для определения сахаролитических свойств культуру с агара пересевают в среду Олькеницкого, в пробирку с маннитом. Посинение среды и пузырьки газа свидетельствуют о ферментации глюкозы, лактозы и маннита. Кишечная палочка не растет на среде Симмонса, не образует сероводорода.
Citrobacter. Идентификация осуществляется по общей схеме. В отличие от микробов рода Escherichia, Citrobacter растут на среде Симмонса, образуют сероводород.
Капсульные бактерии Klebsiella - Enterobacter. Капсульные бактерии рода Klebsiella являются возбудителями пневмонии, риносклеромы, озены. Бактерии рода Enterobacter вызывают заболевания почек и мочевыводящих путей, поражения желудочно-кишечного тракта. Капсульные бактерии представляют собой неподвижные, грамотрицательные палочки с закругленными концами. Располагаются попарно или одиночно и окружены капсулой, которая хорошо выявляется как в патологическом материале, так и в культуре (наблюдаются и бескапсульные варианты). Микробы неприхотливы и хорошо культивируются на обычных питательных средах, растут в виде слизистых, выпуклых серовато-желтых колоний, нередко сливающихся между собой. В бульоне дают диффузный рост, могут образовывать осадок, пленку на поверхности или кольцо - на стенке пробирки. Биохимические свойства изучают в соответствии с принципами идентификации энтеробактерий. По своим свойствам бактерии рода Klebsiella практически неотличимы от Enterobacter. Они слабо расщепляют мочевину, утилизируют цитрат в среде Симмонса и малонат, не образуют сероводород, не имеют дезаминазы фенилаланина, различаются по подвижности, разжижению желатины. Следует учитывать материал, из которого выделен микроорганизм (Klebsiella чаще из мокроты, Enterobacter - из фекалий и мочи). Выделенные культуры капсульных бактерий окрашивают по Граму и Гинсу (с целью выявления капсул).
Hafnia. Биохимические свойства бактерий этого рода изменяются в зависимости от температуры выращивания. Растут на обычных питательных средах: Эндо, Левина, Плоскирева. Образуют серовато-розовые колонии. Не ферментируют лактозу, не образуют индол и сероводород, слабо растут на среде Симмонса, образуют лизиндекарбоксилазу, дают положительную реакцию с метиловым красным при 37° и Фогес-Проскауэра при 22°.
Serratia. Чудесная палочка (Serratia marcescens) - грамотрицательная, почти сферическая. На агаре дает нежные округлые колонии, подвижна. Усвоение углеводов вариабельно. Разжижает желатину, сероводорода и индола не образует.
Proteus. Микроб представляет собой довольно короткую, подвижную грамотрицательную палочку. Хорошо растет на обычных питательных средах. Может давать как изолированные, так и расплывающиеся по поверхности агара колонии (ползучий рост). Большинство свежевыделенных штаммов протея обладает слабой биохимической активностью: ферментирует глюкозу с образованием кислоты и газа и несколько реже сахарозу и мальтозу. Особенностью протея, которая используется при дифференциации, является способность разлагать мочевину. После посева протея на среду Олькеницкого (с мочевиной) последняя приобретает ярко-оранжевое окрашивание. Микробы рода Proteus обладают дезаминазой фенилаланина и разжижают желатину.
Providencia. Микробы этого рода грамотрицательные, подвижные или неподвижные палочки, утилизируют цитрат на среде Симмонса, имеют фермент фенилаланиндезаминазу. В отличие от протея не гидролизуют мочевину.
Неферментирующие грамотрицательные бактерии (НГОБ). Группа характеризуется отсутствием способности осуществлять процессы брожения и включает неферментирующие ГОБ различных родов и семейств (Pseudomonas, Alcaligenes, Moraxella, Actinetobacter, Flavobacterium). Это мелкие или средних размеров палочки, расположенные беспорядочно, парами или короткими цепочками, не образуют спор, многие имеют капсулу, подвижность +/-. Бактериологическая диагностика: посев на кровяной агар, Эндо или Мак-Конки с отбором и пересевом колоний на спец. среду OF (oxidative - fermentative). Культуру засевают в 2 пробирки уколом и одну из них заливают вазелиновым маслом - кислотообразование в обеих пробирках свидетельствует об усвоении углеводов за счет анаэробного расщепления, только без маслоаэробного (табл.3).
Таблица 3
|
Род, вид микроорганизма |
Пигменто- |
Оксидаза |
(Среда с 1% глюкозы) |
Рост на среде Эндо и Мак-Конки |
|
|
окисление аэробно |
ферментация анаэробно |
||||
|
Pseudomonas |
+/- |
+/- |
+ желтеет |
- |
+ |
|
Alcaligenes В. bronchoseptica |
- |
+ |
подщелачивает |
- |
+ |
|
Moraxella Sp. |
- |
+ |
- |
- |
- |
|
Acinetobacter calcoaceticus var. anitratus |
- |
- |
+ |
- |
+ |
|
Acinetobacter calcoaceticus var. ioffi |
- |
- |
- |
- |
+ |
|
Flavobacter |
+ |
+ |
+ |
+ |
- |
Moraxella - крупные слизистые колонии, иногда капсула, повышенная чувствительность к большинству антибиотиков (за исключением линкомицина). Flavobacterium (12 видов) - коккабациллы, растут на простых средах, матовые, желтые, оранжевые, красные, коричневые. На 5% кровяном агаре - зеленят среду. Пигмент зависит от температуры, появляется на 7-й день. Имеют повышенную чувствительность к новобиоцину, эритромицину, хлорамфениколу. Acinetobacter - растут на кровяном и простом агарах - крупные, белые, круглые, слизистые, иногда гемолиз.
Pseudomonas aeruginosa. Синегнойная палочка относится к семейству Pseudomodaceae, представляет собой подвижную, грамотрицательную палочку. На плотных питательных средах она дает крупные плоские слизистые колонии, иногда с гемолизом и металлическим блеском. На жидких питательных средах характерно равномерное помутнение и нежная пленка на поверхности. В отношении углеводов синегнойная палочка не активна, ферментирует только глюкозу с образованием кислоты без газа. Характерной особенностью синегнойной палочки является пигментообразование. Чаще всего она выделяет сине-зеленый пигмент, но описаны также черный и красный пигменты. Признак пигментообразования непостоянен, встречаются и бесцветные штаммы микроба. Культура синегнойной палочки имеет цветочный запах, напоминающий запах фиалок или земляничного мыла; бесцветные штаммы издают неприятный аммиачный запах. Характерным признаком является наличие фермента цитохромоксидазы.
Определение чувствительности микроорганизмов к антибиотикам. При определении лекарственной чувствительности необходимо пользоваться чистой культурой возбудителя. Выделение чистой культуры микроба особенно важно в случаях, где имеется обильная сапрофитная микрофлора (например, мокрота). В других случаях (раны, свищи) возможно определение чувствительности и ассоциаций микробов, так как в 70% данные определения чувствительности на l-м этапе совпадают с последующим определением чувствительности той же культуры. Для определения чувствительности микроорганизмов к химиотерапевтическим препаратам рекомендуются методы диффузии в агар с применением бумажных дисков и метод серийных разведений в двух модификациях (на плотной и жидкой питательных средах).
Метод диффузии. Метод основан на диффузии антибиотика из небольшого фокуса (лунка в агаре, стандартный диск из фильтровальной бумаги, пропитанный антибиотиком) в плотную питательную среду, обычно агар в чашке Петри. Метод диффузии в агар антибиотика из луночек или цилиндриков значительно сложнее, чем использование дисков. Наиболее удовлетворительным и приемлемым для клинических целей считается метод с использованием дисков из фильтровальной бумаги, помещенных на поверхность среды в чашке Петри. Этот метод требует наименьшего труда и при соблюдении стандартности опытов дает достаточно точные результаты. Количество любого антибиотика в дисках зависит от абсолютной активности препарата, скорости, с которой антибиотик диффундирует в среду, концентраций, достигаемых in vivo, и терапевтических концентраций, при различных инфекциях. Для большинства антибиотиков содержание их в диске колеблется от 1 мкг до 50 мкг. В практических условиях рекомендуется пользоваться стандартными дисками, выпускаемыми промышленностью. Определение чувствительности проводится на одной из следующих питательных сред: 1) среда на переваре Хоттингера с содержанием 120-140 мг % аминного азота, 1-2% агара, рН 7,2-7,4; 2) козеиново-дрожжевая среда с таким же содержанием аминного азота и агара и значением рН; 3) мясопептонная среда с таким же содержанием агара и рН. Допускается добавление в среду 5% крови или сыворотки, что не оказывает отрицательного влияния на результаты анализа. Для определения чувствительности в стерильные чашки Петри разливают по 20 мл одной из вышеуказанных питательных сред. Затем на поверхность агара засевают суспензию суточной агаровой культуры исследуемого микроба в сахарном бульоне (1 млрд. микробных тел на 1 мл по оптическому стандарту). Покачиванием чашки культуру равномерно распределяют по поверхности питательной среды, а ее излишек отсасывают пастеровской пипеткой. На поверхность засеянного агара пинцетом накладывают диски с различными антибактериальными препаратами (до 5-6). Чашки выдерживают 30 мин при комнатной температуре (период преддиффузии препаратов в агар), затем помещают в термостат при 37°С на 16-18 часов. Для избежания размывания зон задержки роста конденсационной водой чашки ставят вверх дном. Результаты оценивают по диаметру зоны задержки роста микробов вокруг дисков с антибиотиками, включая диаметр самого диска. Единичные колонии и рост микроорганизмов в виде тонкой пленки вокруг зоны задержки не учитывают. Отсутствие зоны задержки роста микробов указывает на то, что испытуемый штамм устойчив к данному препарату. Зоны диаметром до 10 мм указывают на малую чувствительность, зоны диаметром более 10 мм - на чувствительность микроба.
Таблица 4
Биохимические свойства грамотрицательных бактерий
|
Семейство |
Род микроба |
Подви- |
Среда Олькеницкого |
U |
Маннит |
Цитрат Сим- |
Мало- |
Фенил- |
Жела- |
Лизин |
|||
|
глюкоза |
лактоза |
мочевина |
H2S |
||||||||||
|
Enterobac- |
Escherichia |
+ |
кг |
кг |
- |
- |
+/- |
к |
- |
- |
- |
- |
+/х |
|
Citrobacter |
+ |
кг |
кг |
- |
+/- |
+ |
к |
+ |
- |
- |
- |
- |
|
|
Klebsiella |
- |
кг |
к +/- |
(+) |
- |
- |
к |
+ |
+ |
- |
- |
+ |
|
|
Enterobacter |
+/- |
кг |
кг +/- |
+/- |
- |
- |
к |
+ |
+ |
- |
+ |
+/- |
|
|
Hafnia |
+/- |
+/- |
+/- |
- |
- |
- |
к |
х |
х |
- |
- |
+ |
|
|
Serratia |
+ |
к |
к +/- |
+/- |
- |
- |
к |
+ |
- |
- |
+ |
+ |
|
|
Arisona |
+ |
кг |
х |
- |
+ |
- |
к |
+ |
+ |
- |
(+) |
+ |
|
|
Shigella |
- |
к |
- |
- |
- |
+/- |
к |
- |
- |
- |
- |
+ |
|
|
Salmonella |
+/- |
кг |
к |
- |
+ |
- |
кг |
+ |
- |
- |
- |
+ |
|
|
Proteus |
Proteus |
+ |
кг |
- |
+ |
+/- |
+/- |
к |
+/- |
- |
+ |
+ |
- |
|
Providencia |
+/- |
к+/- |
- |
- |
- |
+ |
- |
+ |
- |
+ |
- |
- |
|
|
Pseudomo- |
Ps. aeruginosa |
+ |
к |
- |
+ |
- |
- |
- |
+ |
+ |
- |
+ |
|
Метод разведений является наиболее точным количественным методом определения чувствительности, так как он позволяет определять величину минимальной подавляющей концентрации антибиотика для испытуемого микроба в определенных стандартных условиях опыта (величина микробной нагрузки, режим инкубации, концентрация препарата, объем питательной среды). Методом разведения пользуются в ряде случаев: 1) при необходимости точного определения минимальной подавляющей концентрации препарата; 2) при определении чувствительности микроорганизмов к антибиотикам, плохо диффундирующим в агар; 3) при изучении комбинированного действия антибиотиков; 4) при определении степени устойчивости при лечении вне терапевтических дозировок с целью получения более высоких концентраций антибиотиков.
Санитарно-бактериологическое исследование воздуха. Исследование воздуха производят с целью определения его общей обсемененности и присутствия санитарно-показательных микроорганизмов. Особенно важно контролировать чистоту воздуха операционных, перевязочных и других помещений хирургического отделения. В настоящее время для оценки санитарно-бактериологического состояния воздуха используют фильтрационные, аспирационные, седиментационные методы. Первые два метода наиболее точные, но требуют наличия специальной аппаратуры (аппарат Кротова, прибор Дьяконова, мембранные фильтры и др.). Наиболее широкое распространение в настоящее время находят седиментационный метод и аспирационный метод с применением аппарата Кротова. При отсутствии специальной аппаратуры можно пользоваться чашечным методом.
Седиментационный метод (механическое осаждение) дает достаточно достоверные данные о бактериальной загрязненности воздуха и может быть использован в любых условиях.
Общую бактериальную загрязненность воздуха (количество непатогенных микроорганизмов в 1 м воздуха) производят на чашках Петри с мясопептонным агаром. При исследовании на санитарно-показательные микроорганизмы (стрептококки, стафилококки) применяют элективные питательные среды - кровяной агар, желточно-солевой агар. Чашки с питательными средами в открытом виде устанавливают в горизонтальном положении и экспонируют 5-10 мин при исследовании на общую обсемененность и 40 мин - на кокковую микрофлору. После инкубации в термостате при 37°С в течение 16-18 часов производят подсчет и идентификацию выросших колоний.
воздуха) производят на чашках Петри с мясопептонным агаром. При исследовании на санитарно-показательные микроорганизмы (стрептококки, стафилококки) применяют элективные питательные среды - кровяной агар, желточно-солевой агар. Чашки с питательными средами в открытом виде устанавливают в горизонтальном положении и экспонируют 5-10 мин при исследовании на общую обсемененность и 40 мин - на кокковую микрофлору. После инкубации в термостате при 37°С в течение 16-18 часов производят подсчет и идентификацию выросших колоний.
Обнаружение в воздухе гемолитического стрептококка группы А, золотистого стафилококка свидетельствует об эпидемическом неблагополучии исследуемых помещений. Допустимые нормы общей обсемененности воздуха хирургических операционных составляют 500 микробов в 1 м до операции и 1000 - после операции. Превышение этих показателей или обнаружение в воздухе санитарно-показательных микроорганизмов требует проведения дополнительной влажной уборки помещения с применением ультрафиолетового облучения и бактерицидных ламп, после чего воздух исследуется повторно.
до операции и 1000 - после операции. Превышение этих показателей или обнаружение в воздухе санитарно-показательных микроорганизмов требует проведения дополнительной влажной уборки помещения с применением ультрафиолетового облучения и бактерицидных ламп, после чего воздух исследуется повторно.
Питательные среды
Мясная вода. Свежее мясо (очищенное от костей, жира и сухожилий) разрезают на мелкие кусочки, заливают двойным объемом водопроводной воды и кипятят в течение часа. После кипячения дают мясной воде отстояться, фильтруют через ватный фильтр и доливают водой до первоначального объема. Приготовленную таким образом мясную воду разливают по бутылям и автоклавируют при 1 атм. (120°С) 30 минут. Если на стенках и дне бутылки образуется осадок, то перед приготовлением бульона мясную воду снова фильтруют.
Мясная вода содержит необходимые для роста микроорганизмов минеральные вещества, белки, углеводы, витамины, мясная вода может длительно храниться в присутствии 1% хлороформа.
Мясопептонный бульон. К мясной воде прибавляют 1% пептона и 0,5% поваренной соли и кипятят при постоянном помешивании. РН среды до стерилизации устанавливают не ниже 8,0, так как после стерилизации среда становится более кислой, то рН в готовом бульоне будет 7,5-7,6. РН устанавливают с помощью раствора углекислого натрия или 20% раствора едкого натрия. Жидкость кипятят в течение 2 часов или автоклавируют 20 минут при 1,25 атм. (115°С), после чего в горячем виде фильтруют через складчатый бумажный фильтр. Готовый мясопептонный бульон должен быть прозрачным и иметь соломенно-желтоватый цвет. После стерилизации, как и при приготовлении всех других сред, проверяют рН. Мясопептонный бульон разливают по пробиркам или флаконам и стерилизуют в автоклаве при 120°, в течение 15-20 минут.
Сахарный бульон. К мясопептонному бульону добавляют 0,25-2% глюкозы (предварительно растворенную в небольшом количестве дистиллированной воды).
Стерилизуют текучим паром 3 дня подряд по 30 мин или в автоклаве при 115°С 30 мин.
Простой питательный агар. Среду готовят впрок из расчета 5,0 сухого агара на 100 мл дистиллированной воды. Агар разводят в кастрюле, замачивают в течение 1 часа, доводят до кипения при постоянном помешивании, фильтруют и разливают по колбам. Стерилизуют в автоклаве при 120°С 20 мин.
Кровяной агар с глюкозой. К растопленному стерильному простому агару добавляют 1% глюкозы, стерилизуют 3 часа в водяной бане, охлаждают примерно до 45°С и добавляют 5% крови. Все тщательно перемешивают и разливают в чашки Петри по 20 мл. Для приготовления агара используют человеческую кровь без добавления антисептиков, кровь кролика, барана или лошади. Готовые чашки хранят в холодильнике.
Сывороточный агар. К растопленному и остуженному простому агару добавляют 20% стерильной сыворотки крупного рогатого скота или лошади, смешивают и разливают по чашкам Петри или пробиркам.
Среда Левинталя (шоколадный агар). К растопленному и охлажденному до 60°С простому агару добавляют 10% дефибринированной крови, перемешивают и помещают на водяную баню на 75-80°С до тех пор, пока цвет агара не станет шоколадным.
Желточно-солевой агар. К растопленному и остуженному простому агару, содержащему 10% хлористого натрия, добавляют 10-20% желточной взвеси. Желток асептически извлекают из яйца, взбалтывают с 50-100 мл физиологического раствора. Агар тщательно смешивают с желточной взвесью и разливают в чашки Петри.
Молочный агар. 100 мл простого агара смешивают с 10 мл снятого и простерилизованного молока. Молоко отстаивают, снимают сливки, разливают по пробиркам по 10 мл и стерилизуют текучим паром 3 дня подряд по 30 мин. Среду разливают по 2-3 мл в пробирки и скашивают.
Молоко с метиленовым синим. К 100 мл обезжиренного стерильного молока прибавляют 2 мл 1% водного раствора метиленового синего. Разливают по пробиркам и стерилизуют текучим паром 3 дня подряд по 30 мин.
Среда Тароцци. Нежирное мясо или печень нарезают мелкими кусочками, взвешивают и заливают тройным количеством (по весу) питательного бульона. После кипячения в течение 30 мин среду фильтруют. Кусочки мяса отмывают на сите водопроводной водой, просушивают и раскладывают по 2-3 кусочка в пробирки и 8-10 кусочков в колбочки. Кусочки мяса заливают бульоном по 5-6 мл в пробирки и 100 мл в колбочки. Стерилизуют при 120°С 30 мин.
Среда с глицерином. К 100 мл 2% мясопептонного агара добавляют 1 мл химически чистого глицерина и 0,3 мл 1,6% спиртового раствора бромтимолового синего (индикатор), стерилизуют при 0,5 атм. 20 мин, разливают в чашки Петри. Готовая среда имеет сине-зеленоватый цвет. При росте стафилококка через 24 часа вокруг штриха с культурой среда желтеет, при росте микрококка - остается без изменения.
Полужидкий агар. На 400 мл бульона Хоттингера добавляют 100 мл дистиллированной воды и 5 г сухого питательного агара. Агар разводят в кастрюле, доводят до кипения и разливают в пробирки по 4 мл. Стерилизуют в автоклаве при 1 атм. 20 минут.
Определение бактериальной желатиназы. В пробирку с 4 мл бульона Хоттингера или пептонной воды засевают исследуемую культуру бактерий, после чего опускают полоску освещенной и проявленной рентгеновской пленки размером 30x5 мм. Посевы инкубируют в термостате при 37°С. При разжижении желатины погруженная часть полоски становится прозрачной, а на дно пробирки выпадает черный осадок (редуцированное серебро). Большинство бактерий, продуцирующих желатиназу, дает положительную реакцию в течение суток. При отрицательном результате посевы выдерживают в термостате 5-7 суток.
Полоски рентгеновской пленки для посева укладывают на дно чашки Петри, покрытой фильтровальной бумагой в 1 слой и автоклавируют при 1 атм. 20 минут.
Среды с углеводами (Гисса). Среды приготавливают из расчета 2 г сухого агара с индикатором ВР и соответствующим углеводом (глюкозой, лактозой, маннитом, сахарозой, мальтозой) на 100 мл холодной дистиллированной воды, тщательно перемешивают, кипятят на слабом огне до полного расплавления агара, после чего фильтруют через ватный фильтр. Горячую среду разливают в пробирки и стерилизуют дробно текучим паром три дня подряд по 30 мин.
Среда Эндо. 5 г сухого агара Эндо расплавляют в 100 мг дистиллированной воды, кипятят 3-5 минут на слабом огне. Горячую среду фильтруют через ватный фильтр и вновь доводят до кипения. Среду остудить до 50°С и разлить в стерильные чашки Петри слоем 4-5 мм, после охлаждения чашки подсушивают в термостате. Горячий агар имеет бледно-розовый цвет, при застывании становится бесцветным. Среду готовят в день использования. Покрасневшая среда к употреблению непригодна.
Среда Олькеницкого. В 500 мл дистиллированной воды растворяют 7,5 г лактозы х.ч., 1,75 г сахарозы х.ч., 1 г глюкозы х.ч., 5 гр. мочевины х.ч., 0,3 г железа сернокислого закисного (соль Мора) и 0,5 г гипосульфита, устанавливают рН 7,4-7,6. Добавляют 23 г сухой среды с сахарозой и индикатором ВР. Все размешивают, кипятят, фильтруют, разливают по пробиркам так, чтобы длина столбика и скоса агара были равны. Стерилизуют при 0,5 атм. 20 минут.
Готовая среда имеет серовато-розоватый цвет. При ферментации глюкозы и лактозы среда синеет, при разложении мочевины - приобретает оранжевое окрашивание, при образовании сероводорода появляется почернение на дне пробирки.
Среда Симмонса (цитратный агар). В 1 л дистиллированной воды растворяют: 0,2 г сернокислого магния (MgSO4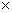 7Н2O)*, 1,5 г фосфорно-кислого натрия аммония (NaNH4HPO4
7Н2O)*, 1,5 г фосфорно-кислого натрия аммония (NaNH4HPO4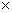 4Н2O), 1 г одноосновного фосфорно-кислого калия (KН2РO4), 3 г лимонно-кислого натрия трехзамещенного (C6H5O7Na3
4Н2O), 1 г одноосновного фосфорно-кислого калия (KН2РO4), 3 г лимонно-кислого натрия трехзамещенного (C6H5O7Na3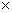 H2O).
H2O).
________________
* Формулы соответствуют оригиналу, здесь и далее по тексту. - Примечание изготовителя базы данных.
К раствору прибавляем 20 г агар-агара, нагреваем до расплавления, устанавливаем рН 7,2 (добавлением 20% NaOH) и прибавляем 1 мл 1,5% спиртового раствора бромтимолового синего. Приготовленную среду фильтруют и разливают в пробирки. Стерилизуют при 1 атм. 15 минут (или как сахара) и скашивают. Готовая среда травянисто-зеленого цвета, при росте микроорганизмов, способных утилизировать цитрат, синеет.
Дрожжевой экстракт. 500 г пекарских дрожжей измельчают и растворяют в 1 л дистиллированной воды, размешивают, разливают по 0,5 л и стерилизуют при 1 атм. 30 мин. Для приготовления сред используют прозрачную часть.
Среда для определения лизинодекарбоксилазы. Гидролизата казеина 0,5%, дрожжевого экстракта - 0,3%, глюкозы 0,5%, 4,5 мл бромтимолового синего (0,1% в 20% спирте), лизина - 0,5%, дистиллированной воды 100 мл, рН-6,0. Разливают в пробирки по 3 мл, стерилизуют текучим паром 3 дня по 30 минут. Готовая среда травянисто-зеленого цвета, при декарбоксилировании лизина - желтого.
Среда с малонатом натрия. В 1 л воды растворяют 2 г сернокислого аммония [(NH4)2SO4], 0,4 г однозамещенного фосфорно-кислого калия (KН2РO4), 0,6 г двузамещенного фосфорно-кислого калия (K2НРO4), 2 г NaCI, 3 г малоната натрия, 0,25 г глюкозы х.ч., 30 мл дрожжевого экстракта и 12 мл 0,2% р-ра бромтимолблау водного.
Растворяют при подогревании плотные части, фильтруют через бумажный фильтр и добавляют индикатор. Разливают в серологические пробирки по 2 мл. Стерилизуют при 112° 30 минут.
Фенилаланиновый агар. В 1 мл воды растворяют 1 г фенилаланина, 1 г двузамещенного фосфорно-кислого натрия (Na2HPO4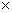 12H2O), 5 г NaCI, 12 г агара (Дифко).
12H2O), 5 г NaCI, 12 г агара (Дифко).
Растворяют при подогревании в воде, фильтруют, разливают в серологические пробирки по 2 мл, стерилизуют при 112° 30 минут и скашивают длинным косяком сразу после стерилизации (среда не должна повторно подогреваться).
Отдельно готовят 10% раствор FeCI3, который является индикатором реакции (не стерилизуют). Несколько капель индикатора добавляют на поверхность роста культуры. При дезаминировании фенилаланина образуется фенилперувинная кислота, в результате на конденсате и косяке появляется зеленое окрашивание.