
Методические рекомендации по организации и проведению эпидемиологического и санитарно-вирусологического надзора за качеством воды водоисточников, питьевой воды в системе водоснабжения с целью профилактики заболеваемости гепатитом А и другими кишечными вирусными инфекциями
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПО ОРГАНИЗАЦИИ И ПРОВЕДЕНИЮ ЭПИДЕМИОЛОГИЧЕСКОГО И САНИТАРНО-ВИРУСОЛОГИЧЕСКОГО НАДЗОРА ЗА КАЧЕСТВОМ ВОДЫ ВОДОИСТОЧНИКОВ, ПИТЬЕВОЙ ВОДЫ В СИСТЕМЕ ВОДОСНАБЖЕНИЯ С ЦЕЛЬЮ ПРОФИЛАКТИКИ ЗАБОЛЕВАЕМОСТИ ГЕПАТИТОМ А и ДРУГИМИ КИШЕЧНЫМИ ВИРУСНЫМИ ИНФЕКЦИЯМИ
УТВЕРЖДАЮ Председатель Государственного Комитета по санитарно-эпидемиологическому надзору РФ E.H.Беляев 11 сентября 1992 года 01-19/12-13
Учреждение-разработчик
НИИ экологии человека и гигиены окружающей среды им. А.Н.Сысина РАМН к.м.н. Недачин А.Е., к.б.н. Дмитриева Р.А., к.м.н. Доскина Т.В., к.м.н. Корнилова Н.М., Лезновенко Э.А. - разделы 1, 2, 3; приложения 1, 2. тел. 245-04-46
Учреждения-соисполнители:
Нижегородский НИИ эпидемиологии и микробиологии профессор Алейник М.Д., к.м.н. Блохин К.В., к.м.н. Быстрова Т.Н., Бурков А.Н. - раздел 3, приложения 3, 5. тел. 33-86-09
НИИ эпидемиологии и микробиологии им. Н.Ф.Гамалеи РАМН - профессор Васильева В.И., к.м.н. Асратян А.А., Као-Минь Нга - раздел 2. тел.193-43-01
НИИ вирусологии им. Д.И.Ивановского РАМН - к.м.н. Счастный Э.И. - раздел 2. тел. 190-28-69
НИИ вирусологии Узбекской АН - к.м.н. Макарова Г.И. - раздел 2, приложение 4. тел. 62-52-24
Методические рекомендации предназначены для центров санэпиднадзора и научно-исследовательских институтов
1. Введение
В настоящее время проблема организации и осуществления контроля вирусного загрязнения водных объектов, а также воды в системе водообеспечения является одной из наиболее актуальных в связи с ростом заболеваемости населения кишечными вирусными инфекциями с фекально-оральным механизмом передачи, распространяемыми на основе реализации водного фактора, являющегося ведущим на ряде территорий страны.
В этих условиях особое значение приобретают вопросы контроля и оценки качества воды водных объектов в отношении возбудителей вирусного гепатита (ВГА) в связи с отсутствием тенденции к регулированию эпидемического процесса данной инфекции, а также вызываемого ею значительного экономического ущерба.
Отсутствие до настоящего времени мер эффективной профилактики в отношении вирусных гепатитов с фекально-оральным механизмом передачи диктует необходимость разработки ускоренных методов индикации их возбудителей во вредных объектах, что чрезвычайно важно для своевременного планирования и проведения комплексных санитарно-гигиенических и противоэпидемических мероприятий, направленных на ограничение циркуляции возбудителей вирусных гепатитов и других кишечных инфекций вирусной этиологии, распространяемых водным путем.
Вирусологический контроль водных объектов окружающей среды, включающий определение в воде колифагов, энтеровирусов и антигена вируса гепатита А, крайне необходим в настоящее время, что нашло отражение в приказе МЗ СССР N 543 от 08.07.88 "О мерах совершенствования и организации работы вирусологических лабораторий", в котором определены задачи практических лабораторий, предусмотрены положения и основные направления работы, а также номенклатура вирусологических исследований лабораториями санитарно-эпидемиологических станций, где наряду с адено- и энтеровирусами предусматривается определение в питьевой воде и воде открытых водоемов возбудителей вирусных гепатитов с фекально-оральным механизмом передачи. Эти задачи также определены Приказом МЗ СССР N 408 от 12.07.89 "О мерах по снижению заболеваемости вирусными гепатитами в стране" (п.2.4).
Однако в практике санитарно-эпидемиологической службы непосредственный вирусологический контроль водных объектов связан с рядом трудностей, таких как слабая оснащенность лабораторий, трудоемкость исследований, требующих специального и дорогостоящего оборудования, диагностикумов, культур тканей и, что является главным, недостаточной разработанностью методических приемов индикации важных вирусов: гепатита А, Е и др.
В связи с вышеизложенным текущий санитарно-вирусологический контроль объектов необходимо осуществлять и с использованием косвенных показателей, что является более экономичным и дает быстрый ответ о степени эпидемической опасности водных объектов в отношении вирусного загрязнения. В соответствии с результатами, полученными по косвенным показателям, проводится прямое определение вирусов, и в том числе антигена вируса гепатита А. Кратность этих исследований определяется врачом-эпидемиологом.
Определение колифагов проводится в бактериологических лабораториях центров санэпиднадзора всех уровней: районных, сельских, городских, областных, республиканских (приложение 1); определение энтеровирусов - в вирусологических лабораториях городских, областных и республиканских центров санэпиднадзора (приложения 2, 3); определение антигена ВГА - в вирусологических лабораториях областных, республиканских центров санэпиднадзора и лабораториях НИИ, имеющих соответствующее оборудование и диагностикумы.
2. Гигиенические и эпидемиологические показания к проведению санитарно-вирусологического контроля водных объектов
2.1. Санитарно-гигиенические показания
Проведение текущего санитарно-эпидемиологического надзора основывается на комплексной оценке санитарного состояния и коммунального благоустройства территории, а также конкретной эпидемической обстановки по заболеваемости населения кишечными инфекциями бактериальной и вирусной этиологии, включая вирусный гепатит А.
Так, при анализе санитарно-гигиенического состояния контролируемых населенных пунктов определяется, насколько соответствуют изучаемые показатели качества воды регламентируемым нормативам. Постоянное неудовлетворительное санитарное состояние изучаемой территории, низкая эффективность работы очистных сооружений, а также несоответствие качества воды различных видов водопользования гигиеническим нормативам свидетельствует о формировании на данной территории ситуации, при которой возникает потенциальная возможность влияния одного или нескольких факторов на интенсивность эпидемического процесса.
Подтверждением этого будут высокие и достоверно различные уровни заболеваемости гепатитом А на контролируемых территориях при наличии статистически достоверных различий между санитарно-гигиеническими показателями сравниваемых территорий.
Нарушение санитарного статуса территорий, представляющее потенциальную эпидемическую опасность или ведущее к возникновению вспышек заболеваний, связанных с водообеспечением населения, происходит в основном по следующим причинам:
- загрязнение воды в зонах санитарной охраны источников хозяйственно-питьевого водоснабжения (выражающееся в несоответствии источников водоснабжения ГОСТ 2761-84 "Источники централизованного хозяйственно-питьевого водоснабжения"), обусловленное нарушением санитарного режима, а также загрязнением сети водоснабжения, в том числе поверхностными стоками во время снеготаяния, проливных дождей, затапливания обширных территорий, а также экологических катастроф и т.д.;
- подача населению питьевой воды, не соответствующей требованиям ГОСТ 2874-82* "Вода питьевая" в результате применения технологии очистки и обеззараживания воды, не соответствующей качеству воды водоисточника или при нарушении процесса водоподготовки;
_______________
* На территории Российской Федерации документ не действует. Действует ГОСТ Р 51232-98. - Примечание изготовителя базы данных.
- неудовлетворительное санитарно-техническое состояние водоочистных сооружений и распределительной системы, нарушение правил их технологической эксплуатации;
- аварийные ситуации и ремонтные работы на очистных сооружениях, канализации, в распределительных сетях, станциях сточных вод; при этом особую опасность представляют аварии на водопроводных и канализационных сооружениях эпидемически значимых объектов, аварийный сброс хозяйственно-бытовых сточных вод;
- технические дефекты или неудовлетворительное санитарно-техническое состояние водозаборных колонок, колодцев (трубчатых, шахтных), нарушение правил их эксплуатации;
- использование в питьевых и хозяйственных целях воды технического водоснабжения и необработанной воды открытых водоемов (арыки, хаузы, каналы).
2.2. Эпидемиологические показания
В настоящее время известно, что значительная доля неидентифицированных острых кишечных инфекций (ОКИ), распространяющихся водным путем, имеют вирусное происхождение. Отмечено также, что росту заболеваемости ГА может предшествовать подъем ОКИ, что свидетельствует об активности факторов передачи, и в том числе водного, на основе которого реализуется развитие эпидемического процесса кишечных инфекций бактериальной и вирусной этиологии.
Поэтому одним из важных показателей, свидетельствующих о необходимости проведения вирусологического обследования питьевой воды и воды водоисточников, является подъем заболеваемости населения, и особенно детей, ОКИ, и в первую очередь, ОКИ неидентифицированной этиологии, особенно на территориях, постоянно неблагополучных по вирусным гепатитам.
Анализ вспышек ГА, связанных с водным фактором, свидетельствует о нескольких вариантах развития вспышечной заболеваемости. Описаны "колодезные", "бочковые", "арычные" вспышки, а также вспышки, связанные с авариями на водопроводе и канализации. Следует иметь в виду, что к вспышкам ГА приводила также контаминация пищевых продуктов водой, загрязненной ВГА. Наконец, зарегистрированы вспышки ГА, связанные с купанием в бассейнах и неконтролируемых водоемах. Острые водные вспышки следует разделять на вспышки с "веерообразной" передачей возбудителя сразу большому количеству людей. При одномоментном заражении весь период заболеваемости ГА ограничивается колебаниями длительности одного инкубационного периода. Такой характер вспышек наблюдается весьма редко. Гораздо чаще бывают вспышки "смешанного" типа, когда возможно взрывообразное (эксплозивное) начало с последующим эпидемическим "хвостом". В данном случае динамика заболеваемости напоминает кривую "нормального распределения" с максимумом в середине всего периода заболеваемости. Наибольшее количество случаев приходится на сроки среднего инкубационного периода, но достаточно много случаев ГА приходится на сроки, в два раза превышающие инкубационный период. При длительном действии фактора передачи определяется более растянутое течение вспышки (эпидемии), которое может намного превышать длительность 2-3 инкубационных периодов. Так как не требуется непосредственного контакта источника инфекции и заражающихся людей, то интенсивность развития и длительность вспышки определяются активностью действия фактора передачи. Поэтому возможны вяло протекающие вспышки ГА, связанные с контаминацией воды в течение достаточно длительного времени.
На территориях с большим количеством источников инфекции и неудовлетворительным состоянием коммунального благоустройства, что приводит к постоянному вирусному загрязнению воды различных видов водопользования, наблюдаются хронические водные эпидемии. Хронические водные эпидемии проявляются постоянно высоким уровнем заболеваемости ГА, сезонными флуктуациями.
Если острые водные вспышки достаточно легко дифференцируются, то длительное действие водного фактора, активизирующееся в определенные месяцы года, требует специальных лабораторных вирусологических исследований и, в частности, проведения исследований за 2-3 месяца до сезонного подъема заболеваемости.
Лабораторный бактериологический и вирусологический анализ воды проводят при следующих эпидемиологических показаниях:
-
1. Нарастание уровня заболеваемости ОКИ на данной территории и в конкретных группах населения в определенные месяцы года.
-
2. Активное вовлечение в эпидемический процесс ОКИ, ГА детских возрастных групп населения (1-2 года, 3-6 лет), независимо от частоты контактов с окружающими; нет преимущественного поражения детей, посещающих детские дошкольные учреждения.
-
3. Возрастание показателей заболеваемости ГА среди групп населения (15-19, 20-29 лет и старше) в связи с более высокими инфицирующими дозами ВГА, которые реализуются при действии водного фактора передачи. Данная тенденция особенно характерна для сельских жителей и лиц, временно находящихся на территориях, гиперэндемичных по ГА.
-
4. Высокая эксплозивность нарастания заболеваемости на микротерриториях и территориальная неравномерность, связанная с водопользованием из открытых водоемов или резервуаров.
-
5. Наличие тесной корреляции между заболеваемостью дошкольников и более старших возрастных групп населения, как правило, с некоторым опережением нарастания активности эпидемического процесса ГА у школьников и в возрастной группе 16-20 лет.
-
6. Особенностью водных вспышек на территориях, гиперэндемичных по ГА, в связи с высокой иммунной прослойкой среди детей и взрослых являются низкие показатели очаговости в семьях. Семейные очаги, где регистрируются 2 и более случаев ГА, составляют менее 30%.
-
7. Во множественных семейных очагах и детских дошкольных учреждениях при воздействии водного фактора передачи инфекции до 70-75% случаев ГА регистрируется с интервалом менее 15 дней, т.е. имеет место одномоментное инфицирование всех членов семьи или коллектива.
-
8. На территориях, относительно благополучных по ГА, в крупных городах развитие подъема заболеваемости в одном или нескольких районах (с общим источником водоснабжения) при сравнительно низком уровне в остальных районах.
-
9. Возникновение внесезонных подъемов заболеваемости ГА и "растянутость" сезонного подъема без тенденции к снижению в течение межэпидемического периода.
Наряду с эпидемиологическими показателями при определении роли водного фактора как вероятной причины высокой заболеваемости ГА, т.е. выявлением причинно-следственных связей, необходимо сопоставить:
- санитарно-технические характеристики территорий, контрастных по уровням заболеваемости в связи с характером водопользования (метод различия);
- отдельные коллективы или территории с высокими показателями заболеваемости при общем водопользовании (метод сходства).
Сопоставление территорий и групп риска для выявления причинно-следственных связей с водным фактором проводится на уровне среднемесячных, среднегодовых, среднемноголетних показателей заболеваемости ГА, качеством воды по микробиологическим показателям. При изучении статистической взаимосвязи между показателями санитарно-гигиенического статуса территории и заболеваемостью ГА необходимо учитывать длительность инкубационного периода ГА, для чего используется соответствующее смещение динамики ее показателей относительно санитарно-гигиенических на 2-3 месяца. Целесообразно отдельно анализировать корреляционные связи санитарно-гигиенического фона с показателями заболеваемости в начале вспышки, эпидемии или сезонного подъема (сроки не более 2-3 инкубационных периодов, т.е. приблизительно 2 месяца).
3. Организация и порядок проведения исследований
В течение года центрами санэпиднадзора страны проводится текущий и по эпидпоказаниям эпидемиологический и санитарно-вирусологический контроль (табл.3.1).
Эпидемиологический контроль динамики заболеваемости ГА должен включать:
- ретроспективный анализ годовой и месячной заболеваемости населения отдельных территорий;
- сравнительный анализ показателей заболеваемости ГА и состояния коммунального благоустройства и водообеспечения населения.
Установленные показатели позволят выделить территории и группы риска, роль водного фактора в передаче возбудителя ГА.
В целях определения уровней инфицированности населения ВГА целесообразно в период подъема и пика заболеваемости ГА проведение исследований по определению маркеров ВГА (антигена ВГА, антител к ВГА класса 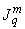 и
и 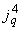 ) у практически здорового населения (дети и взрослые) и у больных ГА.
) у практически здорового населения (дети и взрослые) и у больных ГА.
Наиболее результативным методом этиологической расшифровки водных вспышек является обнаружение антигена ВГА и анти-ВГА класса 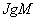 у заболевших вирусным гепатитом.
у заболевших вирусным гепатитом.
Текущий санитарно-вирусологический контроль качества воды объектов по изучаемым показателям обеспечивает своевременное обнаружение сдвига фонового уровня микробного загрязнения прежде всего по колифагам, появление единичных частиц которых в питьевой воде будет свидетельствовать о потенциальной возможности прохождения вирусного загрязнения через барьер водоочистных сооружений. В этом случае необходимо провести повторные исследования воды из данного места на колифаги и при наличии последних отобрать 10 л воды для определения в ней энтеровирусов и антигена ВГА.
Как текущий, так и контроль в период "риска" (за 2-3 месяца до предполагаемого подъема заболеваемости) предусматривают обязательный анализ воды данных объектов на наличие энтеровирусов и антигена ВГА, что позволяет определить степень реальной вирусной контаминации этих объектов и судить о наличии или отсутствии потенциальной опасности возникновения эпидемической ситуации (табл.3.1).
Таблица 3.1
Кратность отбора проб в месяц для санитарно-вирусологического контроля воды питьевой и водоисточников
|
Условия контроля |
Питьевая вода |
Вода водоисточников |
|||||
|
на выходе с водопроводных станций и в тупиковых точках разводящей сети |
поверхностных, подземных |
||||||
|
колифаги |
вирусы |
антиген ВГА |
колифаги |
вирусы |
антиген ВГА |
||
|
Текущий |
1 |
При наличии колифагов |
1 |
При наличии колифагов, превышающем норматив |
|||
|
Период "риска" (VII-Х месяц) |
4 |
2 |
2 |
4 |
1 |
1 |
|
|
По санэпидпоказаниям |
По согласованию с врачом-эпидемиологом, санитарным врачом |
||||||
В случае возникновения ситуации, предусмотренной в разд.2, исследование на наличие кишечных вирусов и антигена ВГА в водных объектах проводится с необходимой частотой по согласованию с эпидемиологом областного или республиканского центров санэпиднадзора.
В приложениях 1, 2, 3, 4, 5 изложены методы:
-
1. Метод выделения колифагов из воды водоисточников и питьевой воды с учетом результатов по НВЧ.
-
2. Метод концентрирования энтеровирусов из воды при помощи ионообменных смол.
-
3. Двухэтапный метод концентрирования антигена вируса гепатита А и энтеровирусов в пробах питьевой воды и воды водоисточников.
-
4. Определение антигена вируса гепатита А в концентрате пробы воды методом радиоиммунного анализа.
-
5. Определение антигена вируса гепатита А в пробах воды методом иммуноферментного анализа.
Приложение 1
МЕТОД ВЫДЕЛЕНИЯ КОЛИФАГОВ ИЗ ПИТЬЕВОЙ ВОДЫ
При текущем надзоре наличие колифага в исследуемой воде определяют качественно, используя методику подращивания. С этой целью в 1 л воды вносят 2 мл суспензии суточной культуры Е.Col в концентрации 10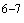 кл/мл и 100 мл мясо-пептонного бульона с десятикратным содержанием хлорида натрия и пептона (10-кратный МПБ). Пробу инкубируют 16-18 часов при 37 °С, после чего тщательно перемешивают, отливают в стерильную пробирку 15-20 мл содержимого, добавляют в нее 2 мл хлороформа и интенсивно встряхивают. Спустя 10-15 минут после осаждения хлороформа отсасывают 10 мл надосадочной жидкости, которые вносят по 2 мл на 5 чашек с 1,5% мясо-пептонным агаром (МПА). Сверху на чашки наслаивают 2,5-3,0 мл расплавленного и остуженного до 45 °С 1,5% МПА, содержащего 0,2 мл взвеси суточной культуры Е.Col. Чашки инкубируют в течение 16-18 часов при 37 °С. При отсутствии колифага в литре исследуемой воды анализ заканчивается. С целью количественного определения колифагов в питьевой воде, анализ проводится далее по следующей схеме.
кл/мл и 100 мл мясо-пептонного бульона с десятикратным содержанием хлорида натрия и пептона (10-кратный МПБ). Пробу инкубируют 16-18 часов при 37 °С, после чего тщательно перемешивают, отливают в стерильную пробирку 15-20 мл содержимого, добавляют в нее 2 мл хлороформа и интенсивно встряхивают. Спустя 10-15 минут после осаждения хлороформа отсасывают 10 мл надосадочной жидкости, которые вносят по 2 мл на 5 чашек с 1,5% мясо-пептонным агаром (МПА). Сверху на чашки наслаивают 2,5-3,0 мл расплавленного и остуженного до 45 °С 1,5% МПА, содержащего 0,2 мл взвеси суточной культуры Е.Col. Чашки инкубируют в течение 16-18 часов при 37 °С. При отсутствии колифага в литре исследуемой воды анализ заканчивается. С целью количественного определения колифагов в питьевой воде, анализ проводится далее по следующей схеме.
СХЕМА ПРОВЕДЕНИЯ ИССЛЕДОВАНИЯ ВОДЫ НА НАЛИЧИЕ ЭНТЕРОВИРУСОВ И АНТИГЕНА ВГА С ИСПОЛЬЗОВАНИЕМ ДВУХЭТАПНОГО МЕТОДА КОНЦЕНТРАЦИИ
Питьевая вода и вода водоисточников - 10 л и более
Сорбция на искусственных или естественных сорбентах
Очистка элюата от балластных белков и бактериальной флоры одним из способов (фреон, эфир, хлороформ и др.)
|
Исследование на энтеровирусы |
Исследование на антиген ВГА |
|||
|
После внесения антибиотиков выделение на первичных и (или) перевиваемых линиях тканевых культур, лабораторных животных с количественным учетом ТЦД |
Осаждение антигенов и вирусов сульфатом аммония |
Ультрацентрифугирование в течение 4 час при 40000 об/мин |
||
|
Идентификация выделенных вирусов в реакции нейтрализации или другими методами |
Исследование концентрата одним из методов: радиоиммунным, иммуноферментным или в РПГА (в зависимости от возможностей лаборатории) |
|||
Примечание. Методы изложены в приложениях 2, 3, 4 с учетом аннотации, приложенной к диагностикуму.
Схема 3.1
Прямой посев: 25 мл исследуемой воды обрабатывают хлороформом вышеуказанным способом, надосадочную жидкость вносят по 5 мл на 4 чашки Петри с 1,5% МПА, сверху наслаивают не менее 5 мл остуженного до 45 °С 1,5% МПА, содержащего взвесь суточной культуры Е.Col и инкубируют 16-18 часов при 37 °С.
Параллельно исследуемую воду разливают по стерильным емкостям в следующих количествах: 500, 200, 100, 50 и 20 мл, в которые вносят суспензию суточной культуры Е.Col в концентрации 10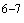 клеток/мл в количестве 1,0 мл, 0,5 мл, 0,5 мл, 0,2 мл и 0,2 мл соответственно и 10% от объема исследуемой пробы 10-кратного МПБ. Пробы инкубируют в течение 16-18 часов при 37 °С.
клеток/мл в количестве 1,0 мл, 0,5 мл, 0,5 мл, 0,2 мл и 0,2 мл соответственно и 10% от объема исследуемой пробы 10-кратного МПБ. Пробы инкубируют в течение 16-18 часов при 37 °С.
Через 16-18 часов проводят учет результатов прямого посева. При наличии колоний колифага (бляшек), их количество на 4 чашках суммируют и умножают на 50, что в итоге дает содержание колифага в БОЕ в 1 л воды. В этом случае инкубируемые объемы воды (500, 200, 100, 50 и 20 мл) сбрасываются и исследование заканчивается.
При отсутствии колифага при прямом посеве работа с вышеуказанными объемами продолжается.
Для этого из каждой емкости (500, 200, 100, 50 и 20 мл после инкубирования в течение 18 часов в термостате) в стерильные пробирки отливают по 10 мл, добавляют в них 1 мл хлороформа, встряхивают и, спустя 10-15 минут после осаждения хлороформа, верхний слой жидкости исследуют на наличие колифага методом агаровых слоев. Для этого в чашки с 1,5% МПА (4 на каждый объем) вносят по 1 мл исследуемой воды из пробирок и по 2,5-3,0 мл расплавленного и остуженного до 45 °С 1,5% МПА с взвесью E.Coli и инкубируют в течение 16-18 часов.
Колифаги на газоне Е.Coli под агаровым покрытием образуют колонии в виде негативных пятен (бляшек), которые и подлежат учету.*
________________
* В сомнительных случаях (дифференцирование от пузырьков воздуха, заросшие посторонней микрофлорой негативные колонии и т.д.) бактериологической петлей извлекают вместе с агаром подозрительный на колифаг участок, помещают в 5 мл МПБ, вносят 1 каплю суточной культуры Е.Coli и инкубируют 16-18 часов. Полученную культуру обрабатывают хлороформом и повторно исследуют на наличие колифага (1 мл и 5-6 десятикратных разведений) по методике, описанной для прямого посева.
Индекс колифага при применении метода обогащения определяют, используя принцип наиболее вероятного числа (НВЧ). В таблице 1 представлены расчетные данные по определению индекса колифага в пробе воды объемом 1 л в зависимости от сочетаний положительных и отрицательных результатов отдельных определений.
Таблица 1
Наиболее вероятное число (НВЧ) колифагов и 95%-е доверительные границы для различных комбинаций положительных и отрицательных результатов при однократном исследовании объемов воды: 500, 200, 100, 50 и 20 мл
|
Результаты выделения колифагов из объемов воды в мл |
НВЧ |
95%-е доверительные границы |
|||||
|
500 |
200 |
100 |
50 |
20 |
нижний предел |
верхний предел |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
+ |
- |
- |
- |
- |
2 |
0,5 |
6 |
|
- |
+ |
- |
- |
- |
1 |
0,5 |
4 |
|
- |
- |
+ |
- |
- |
1 |
0,5 |
4 |
|
- |
- |
- |
+ |
- |
1 |
0,5 |
4 |
|
- |
- |
- |
- |
+ |
1 |
0,5 |
4 |
|
+ |
+ |
- |
- |
- |
4 |
0,5 |
11 |
|
+ |
- |
+ |
- |
- |
4 |
0,5 |
11 |
|
+ |
- |
- |
+ |
- |
3 |
0,5 |
8 |
|
+ |
- |
- |
- |
+ |
3 |
0,5 |
8 |
|
- |
+ |
+ |
- |
- |
4 |
0,5 |
11 |
|
- |
+ |
- |
+ |
- |
3 |
0,5 |
8 |
|
- |
+ |
- |
- |
+ |
3 |
0,5 |
8 |
|
- |
- |
+ |
+ |
- |
2 |
0,5 |
6 |
|
- |
- |
+ |
- |
+ |
2 |
0,5 |
6 |
|
- |
- |
- |
+ |
+ |
2 |
0,5 |
6 |
|
+ |
+ |
+ |
- |
- |
10 |
3 |
23 |
|
+ |
+ |
- |
+ |
- |
9 |
2 |
21 |
|
+ |
+ |
- |
- |
+ |
9 |
2 |
21 |
|
+ |
- |
+ |
+ |
- |
8 |
2 |
19 |
|
+ |
- |
+ |
- |
+ |
7 |
1 |
17 |
|
+ |
- |
- |
+ |
+ |
6 |
0,5 |
16 |
|
- |
+ |
+ |
+ |
- |
9 |
2 |
21 |
|
- |
+ |
+ |
- |
+ |
7 |
1 |
17 |
|
- |
+ |
- |
+ |
+ |
6 |
0,5 |
16 |
|
- |
- |
+ |
+ |
+ |
4 |
0,5 |
11 |
|
+ |
+ |
+ |
+ |
- |
20 |
6 |
61 |
|
+ |
+ |
+ |
- |
+ |
19 |
5 |
56 |
|
+ |
+ |
- |
+ |
+ |
17 |
5 |
47 |
|
+ |
- |
+ |
+ |
+ |
15 |
4 |
37 |
|
- |
+ |
+ |
+ |
+ |
11 |
3 |
26 |
Приложение 2
МЕТОД КОНЦЕНТРИРОВАНИЯ ЭНТЕРОВИРУСОВ ИЗ ВОДОПРОВОДНОЙ И РЕЧНОЙ ВОДЫ С ПОМОЩЬЮ ИОНООБМЕННЫХ СМОЛ
Для концентрирования из водопроводной и речной воды энтеровирусов методом сорбции на искусственных сорбентах применяются ионообменные смолы (производство г.Кемерово) AB-17, AB-17-8, AB-17 2П, ИК или их зарубежные аналоги.
а) Подготовка ионообменных смол для проведения санитарно-вирусологического анализа осуществляется следующим образом: сухую, ионообменную смолу замачивают в течение 2-3 сут в дистиллированной воде. Затем воду сливают и смолу обрабатывают смесью равных объемов свежеприготовленных растворов 2%-ной соляной кислоты и 10%-ного хлорида натрия из расчета 1 л смеси на 100 г смолы. Продолжительность контакта 24 часа. После этого смолу отмывают дистиллированной водой до нейтрального рН 7,0.
б) Перед концентрированием рН исследуемой пробы воды доводят до значений 5,5-6,0.
Для осуществления концентрирования стеклянную бюретку (колонку) диаметром 1,2-1,5 см, к нижнему концу которой присоединен резиновый шланг с завинчивающимся зажимом, устанавливают в штативе строго вертикально. На дно бюретки помещают небольшой слой стекловаты для удержания анионактивной смолы. В колонку вносят суспензию смолы в дистиллированной воде, удаляя через резиновый шланг снизу избыток воды. Заполнение колонки следует проводить тщательно, избегая образования пузырьков воздуха в столбике смолы. Высота столбика смолы 10-12 см.
в) Пробу воды с рН, доведенным 5,5-6,0, располагают выше колонки. Через резиновый шланг с винтовым зажимом на конце воду подают в колонку. Винтовыми зажимами регулируют подачу воды со скоростью 10-12 мл/мин. Зажимом нижнего шланга уравнивают скорость выходящей воды со скоростью подаваемой воды.
г) После окончания концентрирования осуществляют десорбцию вирусов 0,5 М фосфатным буфером с рН 8,2. Для этого в колонку вносят 10 мл фосфатного буфера, интенсивно встряхивают и оставляют в горизонтальном положении в течение 1 час при комнатной температуре или в течение 12-16 час при +4 °С.
Далее элюат переносят в стерильный флакон, доводят рН до 7,0 раствором 1 M соляной кислоты и обрабатывают фреоном, эфиром или хлороформом, затем антибиотиками и микостатином для удаления сопутствующей микрофлоры.
После этого 1-5 мл элюата исследуют на наличие энтеровирусов в тканевых культурах, а оставшуюся часть подвергают ультрацентрифугированию в режиме 40000 об/мин в течение 4 часов для последующего исследования в реакциях пассивной гемагглютинации (РПГА), радиоиммунного анализа (РИА) в твердой фазе или иммуноферментного анализа (ИФА) на наличие антигена вируса ГА.
Приготовление 0,5 М фосфатного буфера с рН 8,2
|
Готовят навески: Na |
||
|
KH |
||
Каждую навеску вносят в отдельную мерную колбу, добавляют дистиллированную воду до объема 1,0 л, растворяют соли. Смешивают 96,9 мл раствора А и 3,1 мл раствора В и одним из этих растворов адъюстируют рН буфера до 8,2.
Приложение 3
ДВУХЭТАПНЫЙ МЕТОД КОНЦЕНТРИРОВАНИЯ АНТИГЕНА ВИРУСА ГЕПАТИТА А И ЭНТЕРОВИРУСОВ В ПРОБАХ ПИТЬЕВОЙ ВОДЫ И ВОДЫ ВОДОИСТОЧНИКОВ
Процесс концентрирования включает в себя два этапа: сорбция-десорбция и осаждение с помощью сульфата аммония.
I этап. В качестве сорбента используют смесь, состоящую из ионообменной смолы AB-17 (см. приложение 2) и гидроксида алюминия (ГОСТ 11841-26*), которой заполняют специальную колонку (можно использовать бюретку со стекловатой для удержания сорбента). Колонка представляет собой стеклянную трубку с размерами: диаметр 36-38 мм, длина 250-300 мм. В нижней части колонки впаивают перегородку из пористого стекла (стеклянный фильтр Шотта N 2). На резиновую трубку, надетую на нижний конец колонки, устанавливают винтовый зажим. Затем в колонку вносят предварительно подготовленную (см. приложение 2) ионообменную смолу (высота столбика смолы должна составлять не менее 30-40 мм) и навеску гидроксида алюминия (8-10 г).
______________
* Вероятно ошибка оригинала. Следует читать: ГОСТ 11841-76. - Примечание изготовителя базы данных.
Исследуемую воду в объеме 30 и более литров подкисляют с помощью соляной кислоты до рН 3,0-4,5 и в соответствующей емкости (лучше стеклянная бутыль на 10 л) располагают выше колонки и подают в нее через резиновую трубку, соединенную со стеклянным дротом, пропущенным через резиновую пробку (NN 36-38). Этой пробкой герметично закрывают верхнее отверстие колонки. Скорость пропускания воды через колонку регулируют с помощью винтового зажима. Она должна составлять 10-15 мл/мин (по числу капель, исходя из расчета, что 20 капель составляют 1 мл).
Вирус (антиген) элюируют 0,05 М глициновым буфером с рН 11,5, который добавляют в объеме 100 мл в колонку после завершения этапа фильтрования и перекрытия винтового зажима. Содержимое тщательно перемешивают и выдерживают в течение 10-15 мин. Затем элюат удаляют из системы, открыв винтовой зажим. С помощью глицинового буфера (рН 1,5) устанавливают рН на уровне 7,0-8,0.
Антимикробную обработку проводят с помощью фреона, эфира или хлороформа, добавляя последний к элюату в соотношении 1:10. Смесь перемешивают в течение 30 мин и центрифугируют при 5000-6000 об/мин в течение 1 час. Супернатант используют для заражения тканевых культур или вторичного концентрирования сульфатом алюминия.
II этап. Вторичное концентрирование (осаждение) вирусов проводят на холоду. К супернатанту дробно (в течение 20-30 мин) добавляют 1/2 объема насыщенного раствора сульфата аммония ((NH )
) SO
SO ), тщательно перемешивают и оставляют на ночь. Утром смесь центрифугируют в течение 1 час при 5000-6000 об/мин. Супернатант сливают, а осадок растворяют в 1-2 мл физиологического раствора с рН 7,2-7,4.
), тщательно перемешивают и оставляют на ночь. Утром смесь центрифугируют в течение 1 час при 5000-6000 об/мин. Супернатант сливают, а осадок растворяют в 1-2 мл физиологического раствора с рН 7,2-7,4.
При необходимости концентрат делят на две части, одну из которых исследуют на наличие антигена ВГА с помощью серологических методов. Другую часть обрабатывают соответствующим образом и используют для заражения тканевых культур по общепринятой методике. При этом необходимо проводить не менее трех пассажей, так как на 1-2 пассажах возможно ЦПД за счет токсичности концентрата.
Настоящая методика обеспечивает концентрирование вирусов в 10-30 тыс. раз и выше, в зависимости от объема исследуемой воды (от 10 до 30 л и более), и позволяет обойтись без сложного дорогостоящего оборудования.
Приготовление глицинового буфера
Навеску 0,385 г аминоуксусной кислоты растворяют в 100 мл воды и получают глицин. К 50 мл глицина добавляют 50 мл 0,1 н раствора гидроксида натрия, получают глициновый буфер с рН 11,5.
Для приготовления глицинового буфера с рН 1,5-1,6 к 38 мл глицина добавляют 62 мл 0,1 н раствора соляной кислоты.
Приготовление насыщенного раствора сульфата аммония
В 1,0 л теплой воды (30-35 °С) растворяют 800 г сульфата аммония ((NH )
) SO
SO ). Полученный раствор фильтруют, доводят до рН 7,2 и охлаждают в рефрижераторе.
). Полученный раствор фильтруют, доводят до рН 7,2 и охлаждают в рефрижераторе.
Приложение 4
ОПРЕДЕЛЕНИЕ АНТИГЕНА ВИРУСА ГЕПАТИТА А МЕТОДОМ РАДИОИММУННОГО АНАЛИЗА
Антиген вируса гепатита А (ВГА-АГ) в концентрированных пробах воды выявляли методом радиоиммунологического анализа (РИА) в его твердофазном варианте.
Принцип метода заключается в следующем.
I этап - сенсибилизация "твердой фазы".
К "твердой фазе" добавляют раствор специфического гаммаглобулина, содержащего анти-ВГА. После контакта избыток антител удаляют, "твердую фазу" отмывают. Антитела в виде слоя молекул остаются прикрепленными к поверхности "твердой фазы".
II этап - взаимодействие со специфическими ВГА-АГ.
К "твердой фазе" с иммобилизованными анти-ВГА добавляют раствор ВГА-АГ (в нашем исследовании - концентрат - элюат воды), который во время инкубации соединяется с антителами, прикрепленными к стенке "твердой фазы", и формируют таким образом иммунный комплекс "антиген-антитело". Избыток непрореагировавшего антигена удаляют, "фазу" отмывают.
III этап - индикация прошедшей реакции.
К "твердой фазе", обработанной, как описано выше, добавляют индикаторные антитела (анти-ВГА), меченные радиоактивным йодом (йод-125). Меченые анти-ВГА прикрепляются к активным центрам ВГА-АГ, входящего в иммунокомплекс, сформированный на предыдущем этапе. Увеличение в исследованной пробе радиоактивности в 2,1 раза, по сравнению с отрицательным контролем оценивается как положительный результат.
В качестве "твердой фазы" использовали пластмассовые пробирки для микропроб емкостью 1,5 мл отечественного производства (ПО "Медполимер", ТУ 64-2-300-80*).
________________
* Документ является авторской разработкой. За дополнительной информацией обратитесь по ссылке. - Примечание изготовителя базы данных.
Источником специфического гамма-глобулина, необходимого для приготовления иммунодиагностикума, служил пул сывороток реконвалесцентов ГА, собранных через 6-12 месяцев после выписки из стационара и имевших в остром периоде анти-ВГА 1 М в диагностическом титре. Маркеры гепатита В не определялись ни в остром, ни в реконвалесцентном периодах. Специфическая активность сывороток реконвалесцентов, определяемая в реакции конкурентной нейтрализации в разведении 1:1000, должна обеспечивать ингибирование тестового ВГА не менее чем на 80%.
Очищенный препарат гамма-глобулина получают путем высаливания сульфатом аммония с последующей доочисткой колоночной хроматографией на ДЕАЕ-сефадексе А-50. Для сорбции на поверхности "твердой фазы" используют фракции, соответствующие верхней трети пика хроматограммы, для йодирования - фракцию, содержащую наибольшую концентрацию белка.
Приготовление индикаторной системы - меченных радиоактивным йодом анти-ВГА - осуществляют по методу .....* (1962) с использованием хлорамина Т.
________________
* Брак оригинала. - Примечание изготовителя базы данных.
Иммобилизацию анти-ВГА на поверхности "твердой фазы" осуществляют в объеме 10 мкл путем обработки пробирок рабочим разведением гамма-глобулина при температуре 42-45 °С в течение 2 час в водяной бане. После двукратного отмывания и дополнительной обработки 1% раствором бычьего сывороточного альбумина в течение 20 минут при том же температурном режиме "твердую фазу" отмывают дважды, просушивают при комнатной температуре и хранят при температуре +4, +10 °С до использования.
Определение ВГА-АГ в воде
Пробы концентрат-элюат размораживают, перемешивают, при наличии хлопьевидного осадка центрифугируют при 3000 об/мин в течение 15 мин или фильтруют через бумажный фильтр. Мелкозернистый осадок на результаты реакции не влияет и удаления не требует. По 10 мкл каждой пробы вносят в сенсибилизированную "твердую фазу" и инкубируют в водяной бане в течение 2 час. После двукратного отмывания в пробирки вносят по 10 мкл меченых анти-ВГА из расчета 10000 имп/мин в 10 мкл метки. Время экспозиции 1 час в тех же условиях. После 6-кратного отмывания остаточную радиоактивность проб просчитывают в гамма-счетчике. (Ультрагамма - 1280, ЛКБ, Швеция). Пробы, радиоактивность которых в 2,1 раза превышает показатели радиоактивности отрицательного контроля, считают положительными и исследуют повторно в реакции нейтрализации.
Реакцию нейтрализации выполняют в двух параллельных пробах. Пробы воды в объеме 10 мкл вносят в две пробирки с иммобилизованными анти-ВГА, инкубируют 2 час в вышеописанных условиях. Затем в одну пробирку добавляют меченый препарат анти-ВГА, смешанный в равных количествах с гамма-глобулином из сыворотки, не содержащей анти-ВГА (контро…..*, а в другую пробирку - меченый препарат анти-ВГА, смешанный в равных количествах с гамма-глобулином из сыворотки, не содержащей анти-ВГА (опыт). Конечное разведение меченого анти-ВГА составляет 10000 имп/мин в 10 мкл, оба вида гамма-глобулина (содержащий и не содержащий анти-ВГА) имеют одинаковую концентрацию по белку. После 1-часовой инкубации в тех же условиях, 6-кратного отмывания и подсчета радиоактивности проводят сравнение результатов двух параллельных проб. Если в опытной пробе уровень радиоактивности на 40% и более ниже, чем в контрольной пробе, результат считают положительным, т.е. в пробе воды содержится ВГА-АГ.
________________
* Брак оригинала. - Примечание изготовителя базы данных.
Приложение 5
ОПРЕДЕЛЕНИЕ АНТИГЕНА ВИРУСА ГЕПАТИТА А В ПРОБАХ ВОДЫ МЕТОДОМ ИММУНОФЕРМЕНТНОГО АНАЛИЗА
Антиген вируса гепатита А определяют в предварительно обработанных пробах воды с применением "Тест-системы иммуноферментной для выявления антигена вируса гепатита А", разработанной и выпускаемой Нижегородским НИИЭМ.
"Тест-система иммуноферментная для выявления антигена вируса гепатита А" представляет собой комплект, состоящий из следующих компонентов:
-
1. Иммуносорбент - 96 луночные полистироловые планшеты с плоским дном с сорбированными антителами к вирусу гепатита А (анти-ВГА), относящимися к иммуноглобулинам класса.
-
2. Конъюгат, представляющий собой анти-ВГА, меченные пероксидазой, выделенные колоночной гель-хроматографией на сефадексе g-200 из сыворотки реконвалесцента ГА и кон"югированные с пероксидазой (RL - 3,о фирмы "Олайне", Рига) периодатным методом по NaKa.....*.
________________
* Брак оригинала. - Примечание изготовителя базы данных.
-
3. Сыворотка крови человека, не содержащая анти-ВГА.
-
4. Положительный контрольный образец - антиген ВГА, полученный методом роллерного культивирования на клетках почек эмбриона макаки, резус (FRhK-4).
-
5. Отрицательный контрольный образец ОК-1 - суспензия клеток - 4, не зараженных ВГА, и отрицательный контрольный образец ОК-2, - 10%-ная водная суспензия фекалий, не содержащий ВГА.
-
6. Твин-80 - детергент.
-
7. Орто-фенилендиамин - субстрат пероксидазы.
-
8. Гидроперит.
-
9. Цитратный буферный раствор.
Набор рассчитан на исследование 96 проб, включая контрольные. Желательно каждую пробу исследовать в трех повторностях.
Определение антигена ВГА в воде (схема анализа)
1. В лунки иммуносорбента A-1, А-2, А-3 внести по 0,05 мл положительного контрольного образца (ПК), в лунки А-4, А-5, А-6 по 0,05 мл отрицательного контрольного образца 1, в лунки А-7, А-8, А-9 по 0,05 мл отрицательного контрольного образца П. В остальные лунки внести по 0,05 мл пробы воды после ультрацентрифугирования. Лунки H-1, Н-2, Н-3 оставить незаполненными. Закрыть планшет крышкой и выдерживать его при температуре 22-26 °С от 16 до 20 час.
2. Приготовить 1 л фосфатно-солевого буферного раствора - 0,01 М с рН 7,2-7,4, содержащего 0,05% твина-80 (ФСБ-Т). Для этого: 2,9 г двузамещенного фосфата натрия (Na HPO
HPO ·12Н
·12Н О), 0,265 г однозамещенного фосфата натрия (NaH
О), 0,265 г однозамещенного фосфата натрия (NaH PO
PO ·12H
·12H O) и 9,0 г хлорида натрия (NaCl) растворить в 1,0 л дистиллированной воды, при перемешивании добавить 0,5 мл твина-80, все перемешать. Раствор ФСБ-Т хранить при температуре 6±2 °С в течение 7 суток.
O) и 9,0 г хлорида натрия (NaCl) растворить в 1,0 л дистиллированной воды, при перемешивании добавить 0,5 мл твина-80, все перемешать. Раствор ФСБ-Т хранить при температуре 6±2 °С в течение 7 суток.
3. Отсосать содержимое лунок в сосуд с 5%-ным раствором монохлорамина с помощью перистальтического или водоструйного насоса и промыть лунки 4 раза ФСБ-Т, заполняя их до краев.
4. Растворить содержимое ампулы с конъюгатом в ФСБ в соответствии с указаниями на этикетке, затем 5 мл разведенного конъюгата внести в ампулу с отрицательной сывороткой ОС, перемешать и полученное содержимое внести по 0,05 мл во все лунки, кроме Н-1, Н-2, Н-3.
5. Закрыть планшет крышкой и выдежить* его при комнатной температуре 37±1 °С в течение 2 часов. Затем отсосать содержимое лунок и промыть 6 раз, как изложено выше п.3.
________________
* Текст документа соответствует оригиналу. - Примечание изготовителя базы данных.
6. Приготовить субстратный раствор. Для этого содержимое ампулы с ФЦБ растворить в 10,0 мл дистиллированной воды. Таблетку гидроперита растворить в 100 мл дистиллированной воды. 0,2 мл раствора гидроперита и содержимое ампулы (4,000 мл) с ОФД растворить в 10,0 мл ФЦБ. Раствор должен быть прозрачным и бесцветным. Смесь не хранят.
7. Во все лунки планшета вносят по 0,1 мл свежеприготовленного субстратного раствора. Планшет выдерживают в темном месте при температуре 22-26 °С в течение 30 минут.
8. Готовят раствор серной кислоты 0,2 моль/дм . Для этого к 80,0 мл дистиллированной воды добавляют 20,0 мл концентрированной серной кислоты, охлаждают.
. Для этого к 80,0 мл дистиллированной воды добавляют 20,0 мл концентрированной серной кислоты, охлаждают.
9. В лунки планшета добавляют по 0,05 мл раствора серной кислоты, 0,2 моль/дм , для остановки реакции и немедленно производят учет результатов.
, для остановки реакции и немедленно производят учет результатов.
Учет результатов
Учет результатов производят в соответствии с рекомендациями, изложенными в наборе "Тест-системы".
 /мл, БОЕ, НВЧ в 1 л
/мл, БОЕ, НВЧ в 1 л