
Изменение N 2 ГОСТ Р 52174-2003 Биологическая безопасность. Сырье и продукты пищевые. Метод идентификации генетически модифицированных источников (ГМИ) растительного происхождения с применением биологического микрочипа
ИЗМЕНЕНИЕ N 2
ГОСТ Р 52174-2003 "Биологическая безопасность. Сырье и продукты пищевые. Метод идентификации генетически модифицированных источников (ГМИ) растительного происхождения с применением биологического микрочипа"
ОКС 65.140, 65.160, 67.060, 67.080, 67.100, 67.120, 67.140,
67.140.30, 67.160, 67.180, 67.190, 67.200, 67.220
Дата введения 2014-07-01
УТВЕРЖДЕНО И ВВЕДЕНО В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 22.11.2013 N 1896-ст
Раздел 1. Второй абзац. Заменить слова: "пяти" на "десяти", "10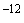 г (1 пг)" на "10
г (1 пг)" на "10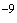 г (1 нг, ~10
г (1 нг, ~10 геном-эквивалентов тотальной растительной ДНК/1 мкл пробы)".
геном-эквивалентов тотальной растительной ДНК/1 мкл пробы)".
Раздел 2 дополнить ссылкой:
"ГОСТ 20015-88 Хлороформ. Технические условия".
Пункты 4.1, 4.2 изложить в новой редакции:
"4.1 Универсальный аппаратно-программный комплекс (УАПК) для анализа биологических микрочипов с компьютерной программой для анализа полученных результатов [1].
4.2 Хлороформ по ГОСТ 20015, х.ч.".
Пункт 4.3. Заменить ссылку: [3] на [2].
Пункт 4.4. Заменить ссылку: [4] на [3].
Пункт 4.8. Заменить ссылку: [5] на [4].
Пункт 4.9. Заменить ссылку: [6] на [5].
Пункт 4.10. Заменить ссылку: [7] на [6].
Пункт 4.13. Заменить ссылку: [8] на [7].
Пункт 4.14. Заменить ссылку: [9] на [8].
Пункт 4.24. Заменить ссылку: [10] на [9].
Пункт 4.25. Заменить ссылку: [11] на [10].
Пункт 4.28 изложить в новой редакции:
"4.28 Цетилтриметиламмоний бромид [11]".
Пункт 4.31 изложить в новой редакции:
"4.31 Фермент термостабильный HotTaq-полимераза для ПЦР с "горячим стартом", оптимум активности при температуре 70 °С - 72 °С [12]".
Пункты 4.33-4.36 изложить в новой редакции:
"4.33 Буфер гибридизационный [13].
4.34 Баня водяная [18].
4.35 Раствор водный дезоксирибонуклеозидтрифосфатов: дАТФ, дГТФ, дУТФ, дЦТФ с молярной концентрацией по 2 мМ каждого [14].
4.36 Раствор флуоресцентного субстрата ФС [15]".
Пункт 4.37. Заменить ссылку: [17] на [16].
Пункт 4.38. Заменить ссылку: [18] на [17].
Пункты 4.39-4.41 изложить в новой редакции:
"4.39 Раствор водный праймеров "ПР-1" для амплификации соответствующих участков генома, включающий следующие пары праймеров [19]:
- праймеры для амплификации фрагмента гена RBCL , кодирующего большую субъединицу рибулозы-1,5 -бифосфат карбоксилазы/оксигеназы (Асc. N Z95552, поз.160-720);
- праймеры для амплификации фрагмента гена лектина LE1 (Асc. N К00821М30884, поз.1080-1720);
- праймеры для амплификации фрагмента гена IVR1 , кодирующего бета-фруктозидазу (Асc. N U16123, поз.300-1090);
- праймеры для амплификации фрагмента 35S -промотора вируса мозаики цветной капусты (Асc. N FM 177585, поз.3560-3870);
- праймеры для амплификации фрагмента 35S -терминатора вируса мозаики цветной капусты (Асc. N FM177585, поз.1260-1590);
- праймеры для амплификации фрагмента 35S -промотора каулимовируса мозаики норичника (FMV , Асc. N Х06166, поз.6260-6630);
- праймеры для амплификации фрагмента терминатора гена белка теплового шока пшеницы (Асc. N Х58279,поз.10-210);
- праймеры для амплификации фрагмента маркерного гена BAR , определяющего устойчивость к фосфинотрицину (Асc. N AY310901, поз.380-920);
- праймеры для амплификации фрагмента терминатора nos из агробактерии Agrobacterium tumefaciens : (Асc. N FM177585, поз.10-370).
4.40 Раствор водный праймеров "ПР-2" для амплификации соответствующих участков генома, включающий следующие пары праймеров [20]:
- праймеры для амплификации фрагмента гена фосфорилазы УДФ-глюкозы (UDP-GP ) (Асc. N D00667, поз.50-310);
- праймеры для амплификации фрагмента гена фосфат-синтазы риса (SPS ) (Асc. N U33175, поз.5910-6250);
- праймеры для амплификации фрагмента маркерного гена nptll из транспозона Тn5 бактериального происхождения (Асc. N EU886197, поз.9792-10145);
- праймеры для амплификации фрагмента терминатора ocs из агробактерии Agrobacterium tumefaciens (Асc. N AJ311872, поз.5050-5240);
- праймеры для амплификации фрагмента терминатора гена RBCS гороха (Асc. N FM177582.1, поз.5782-5920);
- праймеры для амплификации фрагмента промотора гена актина риса АСТ1 (Асc. N S44221, поз.12-380);
- праймеры для амплификации фрагмента маркерного гена gus из бактерии Escherichia coli (Асc. N EU503042, поз.2770-3140).
4.41 Биологический микрочип с иммобилизованными олигонуклеотидами, назначение которых приведено в таблице 1 (название олигонуклеотида соответствует изображенному на рисунке 1) [21]:
Таблица 1 - Обозначение и назначение олигонуклеотидных зондов, иммобилизованных на биологическом микрочипе
|
Наименование олигонуклеотида |
Детектируемая мишень |
Назначение олигонуклеотида |
|
|
pIDNA (rbcL) |
ген RBCL |
Зонд для идентификации ДНК растительного происхождения в анализируемом материале |
|
|
GM/ST1(RBCL) |
ген RBCL |
Видоспецифичный зонд для идентификации ДНК сои и/или картофеля |
|
|
ZM1(RBCL) |
ген RBCL |
Видоспецифичный зонд для идентификации ДНК кукурузы |
|
|
OS1 (RBCL) |
ген RBCL |
Видоспецифичный зонд для идентификации ДНК риса |
|
|
ST1
|
ген RBCL |
Видоспецифичный зонд для идентификации ДНК картофеля |
|
|
GM2(RBCL) |
ген RBCL |
Видоспецифичный зонд для идентификации ДНК сои |
|
|
ZM/OS2(RBCL) |
ген RBCL |
Видоспецифичный зонд для идентификации ДНК кукурузы и/или риса |
|
|
ST2(RBCL) |
ген RBCL |
Видоспецифичный зонд для идентификации ДНК картофеля |
|
|
Le1(Gm) |
ген лектина ( LE1 ) |
Специфичный зонд для идентификации ДНК сои |
|
|
Zein(Zm) |
ген IVR1 |
Специфичный зонд для идентификации ДНК кукурузы |
|
|
UDP-GP (St) |
ген фосфорилазы УДФ-глюкозы |
Специфичный зонд для идентификации ДНК картофеля |
|
|
SPS (Os) |
ген фосфат-синтазы риса |
Специфичный зонд для идентификации ДНК риса |
|
|
nptll |
ген npt |
Специфичный зонд для идентификации маркерного гена nptll из транспозона Тn5 |
|
|
35S_p CAMV |
промотор 35S |
Специфичный зонд для идентификации 35S промотора вируса мозаики цветной капусты |
|
|
35S_p FMV |
промотор FMV |
Специфичный зонд для идентификации 35S FMV промотора каулимовируса мозаики норичника |
|
|
Act1_p |
ген актина АСТ1 |
Специфичный зонд для идентификации промотора гена актина риса |
|
|
Gus |
ген gus |
Специфичный зонд для идентификации маркерного гена gus |
|
|
nos_t |
терминатор nos |
Специфичный зонд для идентификации терминатора nos из агробактерии Agrobacterium tumefaciens |
|
|
35S_t CAMV |
терминатор 35S |
Специфичный зонд для идентификации 35S терминатора вируса мозаики цветной капусты |
|
|
rbcSt |
Терминатор гена RBCS |
Специфичный зонд для идентификации терминатора гена RBCS гороха |
|
|
Ocs_t |
Терминатор Ocs |
Специфичный зонд для идентификации терминатора ocs из агробактерии Agrobacterium tumefaciens |
|
|
Bar |
ген BAR |
Специфичный зонд для идентификации маркерного гена BAR |
|

Рисунок 1 - Схема биологического микрочипа для идентификации генетически модифицированных источников растительного происхождения
Обозначение ячеек приведено в соответствии с назначением иммобилизованного в ней зонда, указанного в таблице 1.
Биологический микрочип представляет собой пластиковую подложку, выполненную в формате предметного стекла по ГОСТ 9284, на поверхности которой в определенном порядке расположена 31 ячейка полиакриламидного геля в форме полусферы диаметром 100 мкм (обозначены кружками на рисунке 1). 22 из них содержат индивидуальный ковалентно иммобилизованный олигонуклеотид (перечень и назначение олигонуклеотидов приведены в таблице 1). Пять ячеек с индексом "0 " не содержат перечисленных индивидуальных ковалентно иммобилизованных олигонуклеотидов и выполняют роль отрицательного контроля гибридизации. Четыре ячейки с индексом "М ", содержат ковалентно связанный флуоресцентный краситель и предназначены для автоматического вычисления интенсивности флуоресценции ячеек биологического микрочипа после гибридизации. Поверхность биологического микрочипа должна быть закрыта специальной составной крышкой с отверстиями, которая вместе с подложкой образует гибридизационную камеру, предназначенную для проведения реакции гибридизации анализируемых ПЦР-продуктов с иммобилизованными на биологическом микрочипе олигонуклеотидами, и исключающую возможность испарения реакционной смеси в процессе гибридизации. Диагностическая специфичность при идентификации растительной ДНК сои, картофеля, кукурузы, риса составляет не менее 95%.
Допускается применение других средств измерений с метрологическими характеристиками, а также оборудования и реактивов с техническими характеристиками не хуже указанных выше".
Пункт 6.1.2. Заменить слова: "186,12 г/дм " на "74,4 г/дм
" на "74,4 г/дм ", "18,61 г" на "7,44 г", "гидроокиси натрия" на "
", "18,61 г" на "7,44 г", "гидроокиси натрия" на "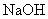 ".
".
Пункты 6.1.4-6.1.9 изложить в новой редакции:
"6.1.4 Приготовление раствора Трис-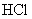 массовой концентрации 242,2 г/дм
массовой концентрации 242,2 г/дм
В колбу вместимостью 100 см помещают 24,22 г трис(оксиметил)аминометана по 4.25 [10] и растворяют приблизительно в 80 см
помещают 24,22 г трис(оксиметил)аминометана по 4.25 [10] и растворяют приблизительно в 80 см особо чистой стерильной воды. Концентрированной соляной кислотой по ГОСТ 3118 доводят рН раствора до 7,5 ед. рН, а объем - до 100 см
особо чистой стерильной воды. Концентрированной соляной кислотой по ГОСТ 3118 доводят рН раствора до 7,5 ед. рН, а объем - до 100 см особо чистой стерильной водой.
особо чистой стерильной водой.
Срок хранения при комнатной температуре - не более 6 мес.
6.1.5 Приготовление раствора 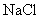 массовой концентрации 146,2 г/дм
массовой концентрации 146,2 г/дм
В плоскодонную колбу вместимостью 100 см помещают 14,62 г хлористого натрия по ГОСТ 4233, растворяют в 70-80 см
помещают 14,62 г хлористого натрия по ГОСТ 4233, растворяют в 70-80 см особо чистой стерильной воды, затем полученный раствор переносят в мерную колбу вместимостью 100 см
особо чистой стерильной воды, затем полученный раствор переносят в мерную колбу вместимостью 100 см и особо чистой стерильной водой доводят объем раствора до метки.
и особо чистой стерильной водой доводят объем раствора до метки.
Срок хранения при комнатной температуре - не более одного года.
6.1.6 Приготовление ЦТАБ-буфера
В стеклянную колбу вместимостью 100 см помещают 2,0 г сухого цетилтриметиламмония бромида по 4.28 [11], далее добавляют 5 см
помещают 2,0 г сухого цетилтриметиламмония бромида по 4.28 [11], далее добавляют 5 см раствора Трис-HCI, приготовленного по 6.1.4, 56 см
раствора Трис-HCI, приготовленного по 6.1.4, 56 см раствора NaCI, приготовленного по 6.1.5, и 10 см
раствора NaCI, приготовленного по 6.1.5, и 10 см раствора ЭДТА, приготовленного по 6.1.2. Объем раствора доводят до 100 см
раствора ЭДТА, приготовленного по 6.1.2. Объем раствора доводят до 100 см особо чистой стерильной водой. Перемешивают на магнитной мешалке до полного растворения соли.
особо чистой стерильной водой. Перемешивают на магнитной мешалке до полного растворения соли.
Срок хранения при комнатной температуре - не более одного года.
6.1.7 Приготовление ЦТАБ-раствора
В стеклянную колбу вместимостью 100 см помещают 0,5 г сухого цетилтриметиламмония бромида по 4.28 [11], и добавляют 1,6 см
помещают 0,5 г сухого цетилтриметиламмония бромида по 4.28 [11], и добавляют 1,6 см раствора
раствора 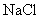 , приготовленного по 6.1.5. Объем раствора доводят до 100 см
, приготовленного по 6.1.5. Объем раствора доводят до 100 см особо чистой стерильной водой.
особо чистой стерильной водой.
Срок хранения при температуре 4 °С - 5 °С - не более месяца, в морозильной камере по ГОСТ 26678 при температуре минус 20 °С - до одного года.
6.1.8 Приготовление разведенного раствора 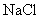
В мерную колбу вместимостью 100 см вносят 48 см
вносят 48 см раствора
раствора 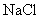 , приготовленного по 6.1.5, и особо чистой стерильной водой доводят объем раствора до метки.
, приготовленного по 6.1.5, и особо чистой стерильной водой доводят объем раствора до метки.
Срок хранения при комнатной температуре - не более 6 мес.
6.1.9 Раствор Taq-полимеразы по 4.31 хранят при температуре минус 20 °С не более шести месяцев. Не допускается хранение раствора Taq-полимеразы ниже температуры минус 23 °С".
Пункты 6.2.1-6.2.6 изложить в новой редакции:
"6.2.1 Две параллельные пробы анализируемого продукта массой около 100 мг каждая помещают в две чистые стерильные микроцентрифужные пробирки по 4.15 вместимостью 1,5 см , добавляют по 500 мм
, добавляют по 500 мм ЦТАБ-буфера, приготовленного по 6.1.6, перемешивают на аппарате для встряхивания по 4.10 [6] в течение 2 мин и выдерживают 15-20 мин при температуре 65 °С в термостате для микропробирок.
ЦТАБ-буфера, приготовленного по 6.1.6, перемешивают на аппарате для встряхивания по 4.10 [6] в течение 2 мин и выдерживают 15-20 мин при температуре 65 °С в термостате для микропробирок.
6.2.2 Микроцентрифужные пробирки со смесью, приготовленной по 6.2.1, центрифугируют при комнатной температуре в настольной центрифуге по 4.8 [4] при частоте вращения 13000 мин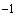 в течение 10 мин.
в течение 10 мин.
6.2.3 Надосадочную жидкость, полученную по 6.2.2, отбирают микродозатором (обычно по 500 мм ) и переносят в чистые микроцентрифужные пробирки, добавляют равный объем хлороформа по ГОСТ 20015. Содержимое перемешивают на аппарате для встряхивания в течение 2 мин и центрифугируют 10 мин при частоте вращения 13000 мин
) и переносят в чистые микроцентрифужные пробирки, добавляют равный объем хлороформа по ГОСТ 20015. Содержимое перемешивают на аппарате для встряхивания в течение 2 мин и центрифугируют 10 мин при частоте вращения 13000 мин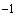 .
.
6.2.4 Верхнюю жидкую фазу из смеси, полученной по 6.2.3, аккуратно отбирают микродозатором в чистые микроцентрифужные пробирки, не захватывая промежуточную или нижнюю фазу. В пробирки добавляют два объема ЦТАБ-раствора, приготовленного по 6.1.7, аккуратно перемешивают, переворачивая пробирки вручную, и выдерживают 60 мин при комнатной температуре.
6.2.5 Смесь, полученную по 6.2.4, центрифугируют 5 мин при частоте вращения 13000 мин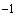 . Надосадочную жидкость тщательно удаляют микродозатором, а осадок растворяют в 350-600 мм
. Надосадочную жидкость тщательно удаляют микродозатором, а осадок растворяют в 350-600 мм (в зависимости от объема осадка) разведенного раствора
(в зависимости от объема осадка) разведенного раствора 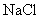 , приготовленного по 6.1.8, добавляют равный объем хлороформа по ГОСТ 20015, перемешивают на аппарате для встряхивания в течение 30 сек и центрифугируют 10 мин при частоте вращения 13000 мин
, приготовленного по 6.1.8, добавляют равный объем хлороформа по ГОСТ 20015, перемешивают на аппарате для встряхивания в течение 30 сек и центрифугируют 10 мин при частоте вращения 13000 мин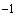 .
.
6.2.6 Надосадочную жидкость, полученную по 6.2.5, отбирают микродозатором и переносят в чистые микроцентрифужные пробирки, добавляют равный объем изопропилового спирта по 4.27, аккуратно перемешивают содержимое пробирок вручную и выдерживают в течение 1 часа при комнатной температуре".
Подраздел 6.2 дополнить пунктами 6.2.7-6.2.9:
"6.2.7 Смесь, полученную по 6.2.6, центрифугируют 10 мин при частоте вращения 13000 мин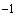 , надосадочную жидкость аккуратно сливают, а к осадку ДНК добавляют 1 см
, надосадочную жидкость аккуратно сливают, а к осадку ДНК добавляют 1 см 70%-ного этилового спирта, приготовленного по 6.1.3 и охлажденного до температуры 0 °С - 4 °С, перемешивают и центрифугируют 5 мин при частоте вращения 13000 мин
70%-ного этилового спирта, приготовленного по 6.1.3 и охлажденного до температуры 0 °С - 4 °С, перемешивают и центрифугируют 5 мин при частоте вращения 13000 мин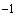 .
.
6.2.8 Полученную надосадочную жидкость вновь тщательно удаляют, а осадок ДНК подсушивают при комнатной температуре до полного удаления этилового спирта, но не более 30 мин.
6.2.9 Осадок ДНК, полученный по 6.2.8, перерастворяют в 40-50 мм особо чистой стерильной воды. Полученный раствор ДНК используют для проведения амПЦР.
особо чистой стерильной воды. Полученный раствор ДНК используют для проведения амПЦР.
Срок хранения раствора ДНК при температуре минус 20 °С - до одного года".
Пункт 6.3.1.1 изложить в новой редакции:
"6.3.1.1 Готовят две микроцентрифужные пробирки вместимостью по 1,5 см и маркируют их "М1" и "М2".
и маркируют их "М1" и "М2".
В пробирку "М1" микродозатором вносят (из расчета на каждую анализируемую пробу): 2,5 мм 10х буфера реакционного для ПЦР по 4.32; 2,5 мм
10х буфера реакционного для ПЦР по 4.32; 2,5 мм смеси дезоксирибонуклеозидтрифосфатов по 4.35 [14], 2 мм
смеси дезоксирибонуклеозидтрифосфатов по 4.35 [14], 2 мм фермента Taq-полимеразы по 4.31 [12] (концентрацией 5 Ед. акт/мм
фермента Taq-полимеразы по 4.31 [12] (концентрацией 5 Ед. акт/мм )*, 1 мм
)*, 1 мм флуоресцентного субстрата ФС по 4.36 [15], а также 1 мм
флуоресцентного субстрата ФС по 4.36 [15], а также 1 мм водного раствора праймеров "ПР-1" по 4.40 [19].
водного раствора праймеров "ПР-1" по 4.40 [19].
_______________
* Срок хранения Taq-полимеразы после разведения при температуре от 2 °С до 8 °С - не более 2 ч.
В пробирку "М2" микродозатором вносят (из расчета на каждую анализируемую пробу): 2,5 мм 10х буфера реакционного для ПЦР по 4.32; 2,5 мм
10х буфера реакционного для ПЦР по 4.32; 2,5 мм смеси дезоксирибонуклеозидтрифосфатов по 4.35 [14], 2 мм
смеси дезоксирибонуклеозидтрифосфатов по 4.35 [14], 2 мм фермента Taq-полимеразы по 4.31 [12] (концентрацией 5 Ед. акт/мм
фермента Taq-полимеразы по 4.31 [12] (концентрацией 5 Ед. акт/мм )*, 1 мм
)*, 1 мм флуоресцентного субстрата ФС по 4.36 [15], а также 1 мм
флуоресцентного субстрата ФС по 4.36 [15], а также 1 мм водного раствора праймеров "ПР-2" по 4.41 [20].
водного раствора праймеров "ПР-2" по 4.41 [20].
_______________
* Срок хранения Taq-полимеразы после разведения при температуре от 2 °С до 8 °С - не более 2 ч.
Смесь разбавляют особо чистой стерильной водой до объема 20 мм (из расчета на одну анализируемую пробу) и осторожно перемешивают в течение 3-5 с на аппарате для встряхивания, не допуская образования пены. Общий объем реакционных смесей в микропробирках "М1" и "М2" для амПЦР готовят с учетом числа анализируемых проб и двух контрольных проб: положительный контроль (заведомо трансгенная ДНК по 4.37) и отрицательный контроль (заведомо нетрансгенная ДНК по 4.38)".
(из расчета на одну анализируемую пробу) и осторожно перемешивают в течение 3-5 с на аппарате для встряхивания, не допуская образования пены. Общий объем реакционных смесей в микропробирках "М1" и "М2" для амПЦР готовят с учетом числа анализируемых проб и двух контрольных проб: положительный контроль (заведомо трансгенная ДНК по 4.37) и отрицательный контроль (заведомо нетрансгенная ДНК по 4.38)".
Пункты 7.1.1-7.1.4 изложить в новой редакции; дополнить пунктами - 7.1.5, 7.1.6:
"7.1.1 Для каждой анализируемой пробы готовят 2 чистые микроцентрифужные пробирки вместимостью 0,2 или 0,5 см , маркируя их "N
, маркируя их "N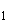 " и "N
" и "N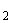 ", где N - номер анализируемой пробы.
", где N - номер анализируемой пробы.
7.1.2 Реакционные смеси для амПЦР "М1" и "М2", полученные по 6.3.1.1-6.3.1.2, микродозатором вносят в микроцентрифужные пробирки по 20 мм в каждую таким образом, чтобы смесь "М1" была распределена по пробиркам с индексом "N
в каждую таким образом, чтобы смесь "М1" была распределена по пробиркам с индексом "N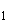 ", а смесь "М2" - по пробиркам с индексом "N
", а смесь "М2" - по пробиркам с индексом "N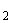 ".
".
7.1.3 Анализируемую ДНК пробы N, выделенную по 6.2, вносят микродозатором по 5 мм в микроцентрифужные пробирки с реакционной смесью для амПЦР по 7.1.2, маркированные, соответственно, "N
в микроцентрифужные пробирки с реакционной смесью для амПЦР по 7.1.2, маркированные, соответственно, "N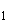 " и "N
" и "N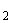 ". При использовании амплификатора ДНК [2] без подогрева крышки в каждую микроцентрифужную пробирку с реакционной смесью вносят по 30 мм
". При использовании амплификатора ДНК [2] без подогрева крышки в каждую микроцентрифужную пробирку с реакционной смесью вносят по 30 мм вазелинового масла по ГОСТ 3164 для предохранения реакционной смеси от испарения водной фазы при амПЦР. В этом случае анализируемую ДНК вносят под слой масла, в результате чего образуются водная и масляная фазы.
вазелинового масла по ГОСТ 3164 для предохранения реакционной смеси от испарения водной фазы при амПЦР. В этом случае анализируемую ДНК вносят под слой масла, в результате чего образуются водная и масляная фазы.
7.1.4 В две другие микроцентрифужные пробирки микродозатором вносят по 5 мм раствора заведомо трансгенной ДНК (положительный контроль).
раствора заведомо трансгенной ДНК (положительный контроль).
7.1.5 Затем еще в две другие микроцентрифужные пробирки микродозатором вносят по 5 мм раствора заведомо нетрансгенной ДНК (отрицательный контроль).
раствора заведомо нетрансгенной ДНК (отрицательный контроль).
7.1.6 Все микроцентрифужные пробирки со смесями, подготовленными по 7.1.3-7.1.5, помещают в амплификатор ДНК и проводят амПЦР по программе, указанной в таблице 2.
Таблица 2 - Программа проведения амПЦР
|
Шаг программы |
Температура, °С |
Время инкубации |
Число циклов |
|
1 |
95 |
12 мин |
1 |
|
2 |
95 |
30 с |
55 |
|
51 |
30 с |
||
|
72 |
30 с |
||
|
3 |
72 |
10 мин |
1 |
Подраздел 7.2 изложить в новой редакции:
"7.2 Гибридизация на биологическом микрочипе
7.2.1 Для проведения этапа гибридизации готовят N+2 микроцентрифужные пробирки вместимостью 0,5 или 1,5 см (N - количество анализируемых проб, две другие пробирки нужны для анализа положительного и отрицательного контроля).
(N - количество анализируемых проб, две другие пробирки нужны для анализа положительного и отрицательного контроля).
7.2.2 В необходимое количество микроцентрифужных пробирок микродозатором вносят по 18 мм гибридизационного буфера 4.33 [13]. К гибридизационному буферу в пробирку "N" добавляют по 9 мм
гибридизационного буфера 4.33 [13]. К гибридизационному буферу в пробирку "N" добавляют по 9 мм водной фазы ПЦР-смесей из пробирок "N
водной фазы ПЦР-смесей из пробирок "N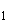 " и "N
" и "N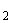 ", полученных в результате проведения амПЦР по 7.1.6 и перемешивают в течение 20-30 с на аппарате для встряхивания по 4.10 с частотой вращения не менее 1500 мин
", полученных в результате проведения амПЦР по 7.1.6 и перемешивают в течение 20-30 с на аппарате для встряхивания по 4.10 с частотой вращения не менее 1500 мин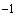 для получения гибридизационной смеси.
для получения гибридизационной смеси.
7.2.3 Из каждой микроцентрифужной пробирки микродозатором отбирают по 34 мм гибридизационной смеси (для каждого биологического микрочипа), полученной по 7.2.2. Смесь вносят через любое из двух отверстий гибридизационной камеры, после чего оба отверстия закрывают крышкой. Гибридизацию проводят в термостате по 4.4 [3] при температуре 37 °С. Минимальное время гибридизации составляет 3 ч. Допускается гибридизация в течение ночи, но не более 16-18 ч.
гибридизационной смеси (для каждого биологического микрочипа), полученной по 7.2.2. Смесь вносят через любое из двух отверстий гибридизационной камеры, после чего оба отверстия закрывают крышкой. Гибридизацию проводят в термостате по 4.4 [3] при температуре 37 °С. Минимальное время гибридизации составляет 3 ч. Допускается гибридизация в течение ночи, но не более 16-18 ч.
7.2.4 После окончания гибридизации крышку реакционной камеры открывают и микродозатором отбирают гибридизационную смесь из камеры микрочипа. В любое из двух отверстий камеры вносят 34 мм дистиллированной воды по ГОСТ 6709, предварительно прогретой до температуры 37 °С. Воду выдерживают в реакционной камере биологического микрочипа в течение 1 минуты, затем отбирают. Процедуру повторяют, после чего составную крышку отсоединяют от подложки. Подложку последовательно промывают дистиллированной водой по ГОСТ 6709, этиловым спиртом по 4.26, дистиллированной водой по ГОСТ 6709 и высушивают при комнатной температуре.
дистиллированной воды по ГОСТ 6709, предварительно прогретой до температуры 37 °С. Воду выдерживают в реакционной камере биологического микрочипа в течение 1 минуты, затем отбирают. Процедуру повторяют, после чего составную крышку отсоединяют от подложки. Подложку последовательно промывают дистиллированной водой по ГОСТ 6709, этиловым спиртом по 4.26, дистиллированной водой по ГОСТ 6709 и высушивают при комнатной температуре.
Схема метода идентификации генетически модифицированных источников (ГМИ) растительного происхождения приведена в приложении Б".
Раздел 8 изложить в новой редакции:
"8 Обработка и интерпретация результатов анализа
8.1 Результаты гибридизации регистрируют с помощью универсального аппаратно-программного комплекса для анализа биочипов (УАПК) [1]. Инсталляция и эксплуатация комплекса осуществляется в соответствии с руководством по эксплуатации УАПК.
8.2 Производят запуск программного обеспечения, поставляемого вместе с комплексом (файл imageware.exe). При запуске на мониторе появляется схема биочипа с указанием отдельных ячеек и обозначением находящихся в них зондов. Названия зондов соответствуют указанным в таблице 1 и на рисунке 1.
8.3 Биологический микрочип после проведения гибридизации, промывки, удаления гибридизационной камеры, ополаскивания и высушивания помещают в держатель УАПК "лицевой" стороной (содержащей гелевые ячейки) вверх.
8.4 Нажимают пиктограмму с надписью "Пуск" в верхней части диалогового окна "Снимок". При этом происходит возбуждение флуоресценции ячеек биочипа лазерами с длиной волны 640 нм, захват флуоресцентного изображения, его обработка и выдача отчета о присутствии в исследуемом образце ДНК растительного происхождения, идентификации видоспецифичной ДНК (соя, кукуруза, картофель, рис) и наличии/отсутствии генетических элементов, используемых как детерминанты трансгенности. Применение универсального аппаратно-программного комплекса (УАПК) для анализа биологических микрочипов [1] позволяет автоматизировать все этапы регистрации и интерпретации результатов и получать заключение о наличии/отсутствии ДНК растительного происхождения в исследуемом образце, а также о наличии/отсутствии генетических детерминант трансгенности.
8.5 Анализ биологических микрочипов с прогибридизованными ПЦР-продуктами, полученными при амплификации ДНК, выделенной из различных образцов, начинают с регистрации и интерпретации гибридизационных картин положительного (заведомо трансгенной ДНК) и отрицательного контроля (заведомо нетрансгенной ДНК).
8.6 Результат анализа ДНК сои, содержащей трансгенные элементы, с использованием гибридизации на биочипе, представлен в приложении В.
8.7 В случае, если при использовании заведомо нетрансгенной ДНК регистрируют сигнал в ячейках, содержащих олигонуклеотиды, комплементарные последовательностям фрагментов векторных конструкций и маркерных генов, это свидетельствует о получении ложноположительного результата. При этом результаты анализа остальных исследуемых образцов не учитываются. Причиной может быть загрязнение (контаминация) ГМИ реактивов и/или оборудования. В этом случае необходимо обработать поверхности лабораторных столов и оборудования раствором соляной кислоты по ГОСТ 3118 (0,1 моль/дм ), заменить реактивы на свежеприготовленные и повторить анализ. В случае отсутствия сигналов в ячейках, содержащих зонды, специфичные к различным генетическим детерминантам трансгенности, при использовании заведомо нетрансгенной ДНК, делают заключение об отсутствии контаминации и проводят анализ образцов ДНК согласно протоколу.
), заменить реактивы на свежеприготовленные и повторить анализ. В случае отсутствия сигналов в ячейках, содержащих зонды, специфичные к различным генетическим детерминантам трансгенности, при использовании заведомо нетрансгенной ДНК, делают заключение об отсутствии контаминации и проводят анализ образцов ДНК согласно протоколу.
8.8 Отсутствие флуоресцентных сигналов в ячейках, содержащих олигонуклеотиды, специфичные к гену RBCL , при использовании нетрансгенной растительной ДНК свидетельствует о получении ложноотрицательного результата. При этом результаты анализа остальных исследуемых образцов не учитываются. Причиной могут быть потеря активности одного из компонентов реакционной смеси для амПЦР или несоблюдение условий проведения амПЦР и/или гибридизации на биологическом микрочипе. В этом случае необходимо заменить реактивы на свежеприготовленные и повторить анализ. Наличие сигнала в ячейках, содержащих олигонуклеотиды, специфичные к ДНК растительного происхождения, при использовании заведомо нетрансгенной ДНК, свидетельствует об эффективно проведенной амПЦР и гибридизации на биочипе. При этом анализ образцов ДНК проводят далее согласно протоколу".
Приложение Б изложить в новой редакции:
"ПРИЛОЖЕНИЕ Б
(справочное)
Схема метода идентификации генетически модифицированных источников растительного происхождения с использованием биологического микрочипа
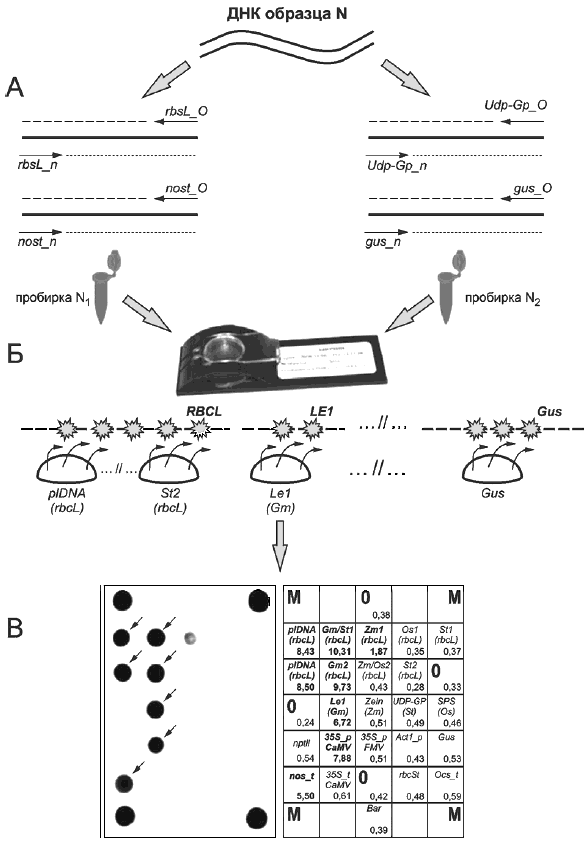
Рисунок Б.1
А - мультиплексная асимметричная амплификация ДНК образца "N" в двух независимых пробирках "N " и "N
" и "N " с уникальным набором праймеров для получения преимущественно одноцепочечных флуоресцентно меченных фрагментов;
" с уникальным набором праймеров для получения преимущественно одноцепочечных флуоресцентно меченных фрагментов;
Б - гибридизация ПЦР-продуктов, полученных в независимых пробирках "N " и "N
" и "N " со специфическими олигонуклеотидами, иммобилизованными на биологическом микрочипе;
" со специфическими олигонуклеотидами, иммобилизованными на биологическом микрочипе;
В - регистрация и интерпретация флуоресцентной картины гибридизации на биологическом микрочипе".
Приложение В изложить в новой редакции:
"ПРИЛОЖЕНИЕ В
(обязательное)
Результат анализа ДНК сои, содержащей трансгенные элементы, с использованием гибридизации на биологическом микрочипе
(флуоресцентная картина гибридизации, полученная в результате анализа ДНК генетически модифицированной сои и распределение нормированных сигналов ячеек биологического микрочипа)
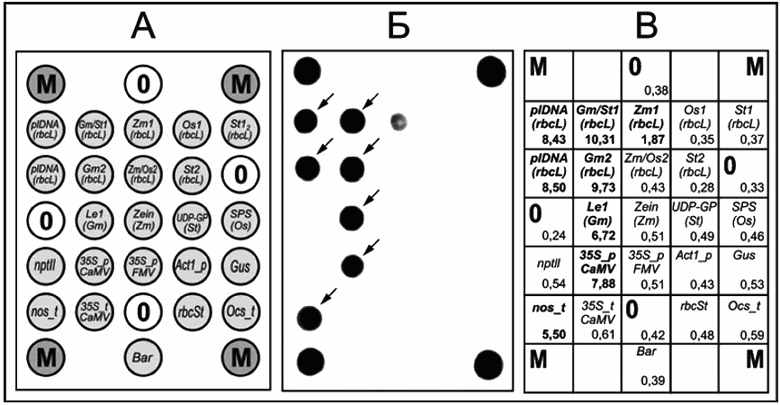
Рисунок В.1
А - схема биологического микрочипа для идентификации генетически модифицированного источника растительного происхождения;
Б - гибридизационная картина на биологическом микрочипе флуоресцентных продуктов амПЦР анализируемой ДНК сои, содержащей 35S -промотор, терминатор nos . Стрелками обозначены ячейки, в которых образовались совершенные гибридизационные дуплексы.
В - распределение нормированных сигналов ячеек биологического микрочипа. Жирным шрифтом выделены ячейки, в которых образовались совершенные гибридизационные дуплексы".
Приложение Г изложить в новой редакции:
"ПРИЛОЖЕНИЕ Г
(рекомендуемое)
Пример оформления протокола испытания
|
Наименование организации (испытательная лаборатория) |
||||||||||||
|
ПРОТОКОЛ ИСПЫТАНИЙ |
||||||||||||
|
N________от "____"______________201__г. Даты: поступления на испытание "__"________201_г. конца испытаний "__"________201_ г. |
||||||||||||
|
Продукция: |
Котлеты "Московские" |
|||||||||||
|
Производитель сырья или продукции: |
ООО "Вымпел" |
|||||||||||
|
Предъявитель сырья или продукции: |
Орган сертификации "Биотест-М" |
|||||||||||
|
Отбор проб произведен |
по ГОСТ 11856-89 |
|||||||||||
|
в соответствии с нормативным документом на соответствующую однородную группу сырья или продукции |
||||||||||||
|
Акт отбора проб и техническое задание на испытания N |
118 |
от 08.02.2013 |
||||||||||
|
Испытания проведены на основании требований ГОСТ Р 52174-2003 |
||||||||||||
|
Номер образца: |
6/кс, 7/кс, 8/кс и 9/кс |
|||||||||||
|
Характеристика испытуемого образца (маркировка, вид и состояние упаковки, этикетки, штриховка): |
||||||||||||
|
Маркировка на упаковке, информирующая о наличии в продукте ГМИ в образцах N 6/кс, 7/кс и 8/кс |
||||||||||||
|
отсутствует, а в образце N 9/кс присутствует. |
||||||||||||
|
Маркировка: |
- |
|||||||||||
|
Годен до: |
- |
Штриховой код: |
- |
|||||||||
|
Результаты испытаний |
||||||||||||
Таблица 1 - Нетрансгенные видоспецифичные последовательности
|
Последовательности |
Номер образца |
||||
|
6/кс |
7/кс |
8/кс |
9/кс |
При наличии |
|
|
ген RBCL |
+ |
+ |
+ |
+ |
|
|
GM/ST1(RBCL) |
+ |
+ |
+ |
+ |
|
|
ZM1(RBCL) |
- |
- |
- |
- |
|
|
OS1 (RBCL) |
- |
- |
- |
- |
|
|
ST1
|
+ |
+ |
- |
- |
|
|
GM2(RBCL) |
- |
- |
+ |
+ |
|
|
ZM/OS2(RBCL) |
- |
- |
- |
- |
|
|
ST2(RBCL) |
+ |
+ |
- |
- |
|
|
Le1(Gm) |
- |
- |
+ |
+ |
|
|
Zein(Zm) |
- |
- |
- |
- |
|
|
UDP-GP (St) |
+ |
+ |
- |
- |
|
|
SPS (Os) |
- |
- |
- |
- |
|
|
Результат анализа: |
В образцах 7/кс и 9/кс обнаружены следующие растительные компоненты: в |
|
|
образце 6/кс и 7/кс обнаружено присутствие ДНК сои, а в образцах 8/кс и 9/кс обнаружено присутствие |
||
|
ДНК картофеля. |
||
Таблица 2 - Трансгенные видоспецифичные последовательности
|
Поcледовательности |
Номер образца |
||||
|
6/кс |
7/кс |
8/кс |
9/кс |
При наличии |
|
|
nptll |
- |
+ |
- |
- |
|
|
35S_p CAMV |
- |
+ |
- |
+ |
|
|
35S_p FMV |
- |
- |
- |
- |
|
|
Act1_p |
- |
- |
- |
- |
|
|
Gus |
- |
- |
- |
- |
|
|
nos _t |
- |
- |
- |
+ |
|
|
35S_t CAMV |
- |
- |
- |
- |
|
|
rbcSt |
- |
- |
- |
- |
|
|
Ocs_t |
- |
- |
- |
- |
|
|
Bar |
- |
- |
- |
- |
|
|
Результат анализа: |
В образцах 7/кс и 9/кс обнаружены следующие трансгенные компоненты: |
|||||
|
в образце 7/кс обнаружен гомолог гена nptll ; промотор 35S CaMV и терминатор nos , а в образце 9/кс |
||||||
|
обнаружены промотор 35S CaMV и терминатор nos . В образцах 6/кс и 8/кс трансгенные компоненты не |
||||||
|
обнаружены. Маркировка на упаковке, информирующая о наличии в продукте ГМИ, в образце 7/кс |
||||||
|
отсутствует, а в образце 9/кс присутствует. |
||||||
|
Вывод: |
Все образцы содержат растительную ДНК, образец 6/кс содержит нетрансгенную ДНК сои; образец 7/кс содержит трансгенную ДНК сои; образец 8/кс содержит нетрансгенную ДНК картофеля; образец 9/кс содержит трансгенную ДНК картофеля. |
|||||
|
Исполнители: |
||||||
|
Иванов И.И. |
||||||
|
подпись |
Фамилия, инициалы |
|||||
|
Петров П.П. |
||||||
|
подпись |
Фамилия, инициалы |
|||||
|
Руководитель испытательной лаборатории |
||||||
|
подпись |
||||||
|
МП |
||||||
|
Фамилия, инициалы |
||||||
Заключение распространяется на образец, представленный на испытания".
Приложение Д изложить в новой редакции:
"ПРИЛОЖЕНИЕ Д
(справочное)
Библиография
|
[1] ТУ 9443-004-02699501-2006* ООО "Биочип-ИМБ" |
Универсальный аппаратно-программный комплекс для анализа биологических микрочипов (УАПК) |
|
________________ * ТУ, упомянутые здесь и далее по тексту, не приводятся. За дополнительной информацией обратитесь по ссылке. - Примечание изготовителя базы данных. |
|
|
[2] ТУ 9642-001-4648062-98 |
Амплификатор "Терцик МС-2" |
|
[3] ТУ 42-619-61 |
Термостат суховоздушный ТВР-25 |
|
[4] Корпорация "Эппендорф", кат. N 5425000.014 |
Микроцентрифуга настольная 5415С, 13000 мин |
|
[5] Корпорация "Хеликон", кат. N MSH-300 |
Мешалка магнитная с подогревом |
|
[6] Корпорация "Хеликон", кат. N CV-1500 |
Аппарат для встряхивания (центрифуга - вортекс) |
|
[7] Корпорация "Хеликон", кат. N RP-30 и RP-80 |
Штативы под микроцентрифужные пробирки |
|
[8] Корпорация "Хеликон", кат. N FA104; FA108; FA111; FA113N |
Наконечники с фильтром для микропипеток |
|
[9] ТУ 6-09-11-1721-83 |
Этилендиаминтетрауксусной кислоты натриевая соль дигидрат |
|
[10] ТУ 6-09-4292-76 |
Трис(оксиметил)аминометан |
|
[11] Корпорация "Хеликон", кат. N Аm-0833 |
Цетилтриметиламмоний бромид (ЦТАБ) |
|
[12] Корпорация "Силекс", кат. N Е0320 |
Фермент HotTaq-полимераза 5 Ед. акт. в мм |
|
[13] ТУ 9398-003-02699501-2006 |
Буфер гибридизационный |
|
[14] Корпорация "Силекс", кат. N N1101 |
Раствор смеси дАТФ, дГТФ, дТТФ, дЦТФ, по 25 мМ каждого |
|
[15] Федеральное государственное бюджетное учреждение науки Институт молекулярной биологии им.В.А.Энгельгардта Российской Академии наук (ИМБ РАН) |
Флуоресцентный субстрат "ФС" |
|
[16] Федеральное государственное бюджетное учреждение науки Институт физиологии растений им.К.А.Тимирязева Российской Академии наук (ИФР РАН) |
Раствор заведомо трансгенной ДНК около 100 нг/мм |
|
[17] Федеральное государственное бюджетное учреждение науки Институт физиологии растений им.К.А.Тимирязева Российской Академии наук (ИФР РАН) |
Раствор заведомо нетрансгенной ДНК около 100 нг/мм |
|
[18] ТУ 46-22-603-75 |
Баня водяная с электрическим или огневым подогревом |
|
[19] Федеральное государственное бюджетное учреждение науки Институт молекулярной биологии им.В.А.Энгельгардта Российской Академии наук (ИМБ РАН) |
Раствор водный праймеров "ПР-1" |
|
[20] Федеральное государственное бюджетное учреждение науки Институт молекулярной биологии им.В.А.Энгельгардта Российской Академии наук (ИМБ РАН) |
Раствор водный праймеров "ПР-2" |
|
[21] Федеральное государственное бюджетное учреждение науки Институт молекулярной биологии им.В.А.Энгельгардта Российской Академии наук (ИМБ РАН) |
Биологические микрочипы (биочипы) гелевые с иммобилизованными олигонуклеотидами |
|
[22] Государственный Комитет Санэпиднадзора Российской Федерации; N 06-19/52-17 от 15.06.95 |
Методические рекомендации по проведению работ в диагностических лабораториях, использующих метод полимеразной цепной реакции. Основные положения* |
|
________________ * На территории Российской Федерации документ не действует. Действуют МУ 1.3.2569-09. - Примечание изготовителя базы данных. |
|
|
[23] ЗАО "НПФ ДНК-Технология" |
Компьютерная программа "Gene" для учета и интерпретации результатов, полученных при помощи ПЦР-детектора "Джин" |
|
[24] ТУ 9443-005-46482062-2003 |
ПЦР-детектор "Джин" |
|
[25] ООО "БИОМАСТЕР-ПРОМ" |
Комплекты реагентов для ПЦР-амплификации ДНК "CKAH- 35S ", "CKAH- gus ", "CKAH- nos " и "СКАН- npt ". |
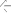
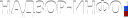
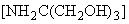
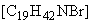
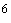 копий/мм
копий/мм